2026年高考领航卷化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年高考领航卷化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
8. $S_{2}Cl_{2}$、$SCl_{2}$均具有较强的毒性,向熔融的硫中通入适量的$Cl_{2}$即可生成,在有机合成、橡胶工业等领域有着广泛的应用。它们的分子中所有原子均满足最外层8电子稳定结构,遇水均能水解,且产物相同。已知:$K_{sp}(AgCl)=1.8× 10^{-10}$、$K_{sp}(Ag_{2}CrO_{4})=2.0× 10^{-12}$。下列说法错误的是
A.$S_{2}Cl_{2}$、$SCl_{2}$分子中的中心原子采用$sp^{3}$杂化
B.制备$S_{2}Cl_{2}$、$SCl_{2}$时产生的尾气应用澄清石灰水处理
C.$S_{2}Cl_{2}$水解的化学方程式是$2S_{2}Cl_{2}+2H_{2}O=4HCl+SO_{2}\uparrow +3S\downarrow$
D.一定质量的$S_{2}Cl_{2}$、$SCl_{2}$溶于水,用$AgNO_{3}$溶液滴定其中的$Cl^{-}$,$K_{2}CrO_{4}$可作指示剂
A.$S_{2}Cl_{2}$、$SCl_{2}$分子中的中心原子采用$sp^{3}$杂化
B.制备$S_{2}Cl_{2}$、$SCl_{2}$时产生的尾气应用澄清石灰水处理
C.$S_{2}Cl_{2}$水解的化学方程式是$2S_{2}Cl_{2}+2H_{2}O=4HCl+SO_{2}\uparrow +3S\downarrow$
D.一定质量的$S_{2}Cl_{2}$、$SCl_{2}$溶于水,用$AgNO_{3}$溶液滴定其中的$Cl^{-}$,$K_{2}CrO_{4}$可作指示剂
答案:
8.B 新物质的性质 S₂Cl₂、SCl₂分子中所有原子均满足最外层8电子稳定结构,中心原子S的价层电子对数均为4,均采用sp³杂化,A正确;尾气中含有Cl₂,Cl₂有毒,可用浓NaOH溶液吸收,防止污染大气,不能用澄清石灰水吸收,澄清石灰水中Ca(OH)₂浓度较低,吸收效果差,B错误;S₂Cl₂分子中的S为 + 1价,遇水能水解,发生歧化反应生成HCl、SO₂、S,根据化合价升降守恒、电荷守恒、原子守恒,即可得到反应的化学方程式,C正确;Ag₂CrO₄(s) + 2Cl⁻(aq) ⇌ 2AgCl(s) + CrO₄²⁻(aq)的平衡常数K = $\frac{c(CrO₄²⁻)}{c²(Cl⁻)}$ = $\frac{c(CrO₄²⁻)·c²(Ag⁺)}{c²(Cl⁻)·c²(Ag⁺)}$ = $\frac{K_{sp}(Ag₂CrO₄)}{K_{sp}²(AgCl)}$ = $\frac{2.0×10⁻¹²}{(1.8×10⁻¹⁰)²}$ ≈ 6.2×10⁷ > 10⁵,Ag₂CrO₄(s)可完全转化为AgCl(s),AgCl沉淀完全时才产生Ag₂CrO₄沉淀,K₂CrO₄可作AgNO₃滴定Cl⁻的指示剂,D正确。
9. 从微观视角探析物质结构及性质是研究和学习化学的重要方法。下列事实与解释相符的是


答案:
9.B 微观粒子结构与性质 原子半径:Cl < Br,Cl—Cl键能(242.7kJ·mol⁻¹)大于Br—Br键能(193.7kJ·mol⁻¹),断键时需要消耗更多的能量,但Cl原子电负性较大,与H原子形成新键时释放的能量更多,且反应活化能更低,使得Cl₂在化学反应中更易发生旧键的断裂与新键的形成,A错误。CO₂中C原子是sp杂化,键角为180°;SO₄²⁻中S原子是sp³杂化,键角约为109°28',中心原子杂化轨道数越多,键角越小,该实例与解释均正确且相符,B正确。NH₄⁺虽然能水解产生H⁺,但H⁺浓度很低,Mg(OH)₂(s) ⇌ Mg²⁺(aq) + 2OH⁻(aq),OH⁻浓度也很低,两者反应进行程度小,NH₄⁺浓度大,会与Mg(OH)₂溶解产生的OH⁻结合生成弱电解质NH₃·H₂O,反应方程式为Mg(OH)₂ + 2NH₄⁺ ⇌ Mg²⁺ + 2NH₃·H₂O,降低了溶液中OH⁻浓度,促使Mg(OH)₂的溶解平衡正向移动,最终完全溶解,C错误。Ca的金属活动性比Na的金属活动性强,但Na的熔点较低(97.8℃),Na与H₂O反应放出的热量可使Na熔化,增大了Na与H₂O的接触面积,反应剧烈,Ca的熔点较高(839℃),且Ca与水反应生成的Ca(OH)₂是一种微溶物,附着在Ca表面,阻碍Ca与H₂O进一步反应,使反应难以进行,D错误。
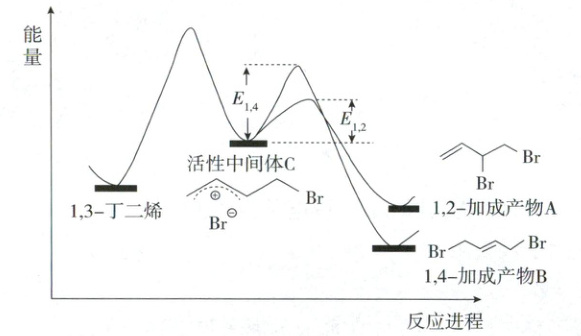
10. 已知1,3 - 丁二烯和$Br_{2}$按物质的量之比1:1加成时,能量 - 反应进程图如图所示。
不同反应条件下,经过相同时间,测得生成物的组成见下表:

下列分析不合理的是
A.产物A、B互为同分异构体,由活性中间体C生成A、B的反应互相竞争
B.相同条件下由活性中间体C生成产物A的速率更快
C.实验1测定产物组成时,体系已达平衡状态
D.实验1在$t$ min时,若升高温度至$25^{\circ}C$,部分产物A会经活性中间体C转化成产物B

不同反应条件下,经过相同时间,测得生成物的组成见下表:

下列分析不合理的是
A.产物A、B互为同分异构体,由活性中间体C生成A、B的反应互相竞争
B.相同条件下由活性中间体C生成产物A的速率更快
C.实验1测定产物组成时,体系已达平衡状态
D.实验1在$t$ min时,若升高温度至$25^{\circ}C$,部分产物A会经活性中间体C转化成产物B
答案:
10.C 竞争反应与能量变化 产物A(1,2 - 加成反应)和B(1,4 - 加成反应)分子式相同,结构不同,互为同分异构体,由活性中间体C出发,1,2 - 加成反应与1,4 - 加成反应的活化能不同,活化能越小,反应速率越快,生成A、B的反应互相竞争,A正确;相同条件下,由活性中间体C生成产物A和B时,1,2 - 加成反应的活化能小,在较低温度时,反应的活化能不容易被克服,生成A的速率更快,B正确;实验1在 - 15℃下进行,测定的产物组成中产物A占多数,产物B能量更低,B更稳定(25℃时B占88%),如果体系已达平衡,低温下也应偏向生成更稳定的B,但实验1中A占62%,表明体系未达平衡状态,而是主要受反应速率的影响,C错误;实验1中A占比高,升高温度后,A会通过活性中间体C转化为更稳定的B,导致B占比升高,D正确。
查看更多完整答案,请扫码查看


