2026年高考领航卷化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年高考领航卷化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
10.【2026届浙江省A9协作体联考】卤代烃的水解存在两种机理,分别用$S_{N}1$和$S_{N}2$表示。(X:F、Cl、Br、I)
$S_{N}1$:(卤代烃容易形成碳正离子中间体,存在重排现象以形成更稳定的中间体)
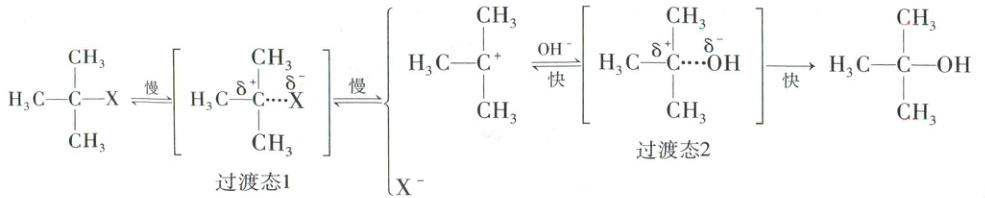
$S_{N}2$:(卤代烃相对不易形成碳正离子,无中间体;中心碳周围空间位阻小,$OH^{-}$可直接从X的背面进攻中心碳)
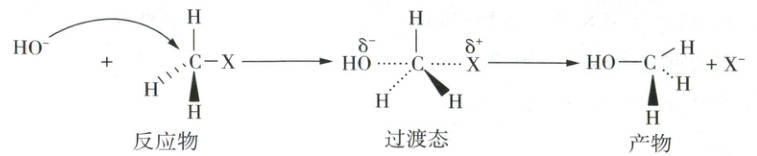
下列说法错误的是
A.增大$c(OH^{-})$对机理$S_{N}1$的反应速率几乎无影响,但对机理$S_{N}2$的速率影响呈正相关
B.相同条件下,水环境中溴代烷发生$S_{N}1$水解的速率大小:$(CH_{3})_{3}CBr$>$(CH_{3})_{2}CHBr$>$CH_{3}CH_{2}Br$>$CH_{3}Br$
C. 不容易发生$S_{N}1$水解,容易发生$S_{N}2$的水解
不容易发生$S_{N}1$水解,容易发生$S_{N}2$的水解
D.$(CH_{3})_{3}CCH_{2}Br$发生$S_{N}1$水解反应,在重排作用下,生成更多的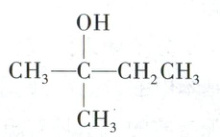
$S_{N}1$:(卤代烃容易形成碳正离子中间体,存在重排现象以形成更稳定的中间体)

$S_{N}2$:(卤代烃相对不易形成碳正离子,无中间体;中心碳周围空间位阻小,$OH^{-}$可直接从X的背面进攻中心碳)

下列说法错误的是
A.增大$c(OH^{-})$对机理$S_{N}1$的反应速率几乎无影响,但对机理$S_{N}2$的速率影响呈正相关
B.相同条件下,水环境中溴代烷发生$S_{N}1$水解的速率大小:$(CH_{3})_{3}CBr$>$(CH_{3})_{2}CHBr$>$CH_{3}CH_{2}Br$>$CH_{3}Br$
C.
 不容易发生$S_{N}1$水解,容易发生$S_{N}2$的水解
不容易发生$S_{N}1$水解,容易发生$S_{N}2$的水解D.$(CH_{3})_{3}CCH_{2}Br$发生$S_{N}1$水解反应,在重排作用下,生成更多的

答案:
10.C 卤代烃水解机理分析 机理Sₙ1的反应决速步为碳正离子的形成,仅与卤代烃浓度相关,增大c(OH⁻)对总反应速率几乎无影响;机理Sₙ2为一步反应,与卤代烃、OH⁻浓度均相关,增大c(OH⁻)会加快反应速率,A正确。机理Sₙ1的反应速率取决于碳正离子稳定性,形成的碳正离子越稳定,反应速率越大,叔碳正离子拥有更多烷基取代基,可通过超共轭效应和给电子诱导效应分散正电荷,结构更稳定,稳定性:叔碳正离子>仲碳正离子>伯碳正离子>甲基碳正离子,对应溴代烷水解速率(CH₃)₃CBr>(CH₃)₂CHBr>CH₃CH₂Br>CH₃Br,B正确。该氯代烃中,与Cl直接相连的碳因环刚性无法形成平面碳正离子(Sₙ1难),且空间位阻极大,阻碍OH⁻从Cl的背面进攻(Sₙ2亦难),C错误。(CH₃)₃CCH₂Br形成的伯碳正离子(CH₃—C—CH₂⁺)不稳定,会发生甲基迁移,重排为更稳定的叔碳正离子,进而生成CH₃—C—CH₂CH₃,D正确。
11.【2026届浙江省A9协作体联考】某市售葡萄糖酸亚铁补铁剂,标注含Fe量为5mg·mL$^{-1}$,现按下列步骤测定实际Fe含量:
已知:邻二氮菲(phen): 可以与$Fe^{2+}$形成橘黄色配合物$[Fe(phen)_{3}]^{2+}$,该配合物的吸光度A与配合物浓度成正比。线性回归方程:$A\approx 150× Q + 0.02$(Q为$Fe^{2+}$浓度,单位:mg·mL$^{-1}$)
可以与$Fe^{2+}$形成橘黄色配合物$[Fe(phen)_{3}]^{2+}$,该配合物的吸光度A与配合物浓度成正比。线性回归方程:$A\approx 150× Q + 0.02$(Q为$Fe^{2+}$浓度,单位:mg·mL$^{-1}$)

下列说法错误的是
A.若改用酸性高锰酸钾溶液测定补铁剂,结果Fe含量超过5mg·mL$^{-1}$,可能是因为补铁剂中还存在其他还原性物质
B.步骤Ⅱ,加入盐酸羟胺的目的是防止溶液中$Fe^{2+}$被氧化,提高测定结果的准确性
C.步骤Ⅱ,加入缓冲液可以维持pH相对稳定,若pH过低,会导致吸光度A偏高
D.步骤Ⅲ测得吸光度A=0.74,则原补铁剂中Fe的实际含量为4.8mg·mL$^{-1}$
已知:邻二氮菲(phen):
 可以与$Fe^{2+}$形成橘黄色配合物$[Fe(phen)_{3}]^{2+}$,该配合物的吸光度A与配合物浓度成正比。线性回归方程:$A\approx 150× Q + 0.02$(Q为$Fe^{2+}$浓度,单位:mg·mL$^{-1}$)
可以与$Fe^{2+}$形成橘黄色配合物$[Fe(phen)_{3}]^{2+}$,该配合物的吸光度A与配合物浓度成正比。线性回归方程:$A\approx 150× Q + 0.02$(Q为$Fe^{2+}$浓度,单位:mg·mL$^{-1}$)
下列说法错误的是
A.若改用酸性高锰酸钾溶液测定补铁剂,结果Fe含量超过5mg·mL$^{-1}$,可能是因为补铁剂中还存在其他还原性物质
B.步骤Ⅱ,加入盐酸羟胺的目的是防止溶液中$Fe^{2+}$被氧化,提高测定结果的准确性
C.步骤Ⅱ,加入缓冲液可以维持pH相对稳定,若pH过低,会导致吸光度A偏高
D.步骤Ⅲ测得吸光度A=0.74,则原补铁剂中Fe的实际含量为4.8mg·mL$^{-1}$
答案:
11.C 定量测定实验分析 酸性高锰酸钾溶液具有强氧化性,若补铁剂中存在其他还原性物质,会与高锰酸钾反应,导致消耗高锰酸钾溶液的体积偏大,计算出的Fe含量偏高,A正确;盐酸羟胺是还原剂,可防止Fe²⁺被氧化为Fe³⁺(邻二氮菲仅与Fe²⁺显色),确保Fe²⁺完全参与配位,提高测定结果的准确性,B正确;pH过低时,邻二氮菲中的N原子易结合H⁺,降低其与Fe²⁺的配位能力,导致配合物[Fe(phen)₃]²⁺浓度减小,吸光度A偏低,C错误;将A=0.74代入线性回归方程,得0.74 = 150Q + 0.02,解得Q = $\frac{0.74 - 0.02}{150}$mg·mL⁻¹ = 0.0048mg·mL⁻¹,则显色液中Fe总量 = 0.0048mg·mL⁻¹×50mL = 0.24mg,其来源于步骤Ⅰ中5.00mL稀释液,原补铁剂中Fe的浓度c = $\frac{0.24mg×\frac{5}{100}}{1mL}$×100%,解得c = 4.8mg·mL⁻¹,D正确。
查看更多完整答案,请扫码查看


