2026年高考领航卷化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年高考领航卷化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
17. (14分)高铁酸钾是一种高效多功能水处理剂,其氧化性强且兼具吸附、絮凝等作用。高铁酸钾为粉末状晶体,呈紫黑色,易溶于水,易分解。用湿式氧化法(次氯酸盐氧化法)制备高铁酸钾的基本步骤如下。
步骤1:取一定体积NaClO溶液于三口烧瓶中,冰水浴,加入一定量NaOH固体,搅拌均匀。
步骤2:向上述溶液中分批加入一定量的Fe(NO₃)₃·9H₂O固体,不断搅拌,观察溶液颜色变化,待反应完毕,得到Na₂FeO₄粗产品。
步骤3:配制一定量的饱和KOH溶液,取20mL加入上述三口烧瓶中,冷却结晶,减压过滤,得到K₂FeO₄粗产品。
步骤4:依次用3mol·L⁻¹KOH溶液、正戊烷、甲醇洗涤粗产品,最后置于60℃真空烘箱中干燥,得到纯度较高的K₂FeO₄产品。
回答下列问题:
(1) 根据步骤1和步骤2,写出制备高铁酸钠的化学方程式______。
(2) 实验过程中要通过冰水浴、分批加入等方式维持低温环境,目的是______。
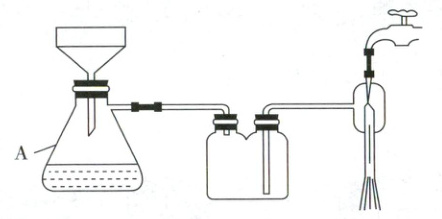
(3) 步骤3中减压过滤装置如图,装置A的名称是______,相较于普通过滤,减压过滤的优点有______。
(4) 如何确认产品是否洗涤干净?写出必要的实验操作及现象______。
(5) 测定高铁酸钾产品纯度:取1.32g样品与过量KI溶液充分反应后配成100mL溶液,取10.00mL待测液,加入少量淀粉溶液作指示剂,用0.1000mol·L⁻¹Na₂S₂O₃标准溶液滴定,重复实验三次,消耗Na₂S₂O₃溶液平均体积为19.20mL。滴定终点现象为______,样品中高铁酸钾的质量分数为______%。(保留3位有效数字,已知:I₂ + 2S₂O₃²⁻ = 2I⁻ + S₄O₆²⁻)
步骤1:取一定体积NaClO溶液于三口烧瓶中,冰水浴,加入一定量NaOH固体,搅拌均匀。
步骤2:向上述溶液中分批加入一定量的Fe(NO₃)₃·9H₂O固体,不断搅拌,观察溶液颜色变化,待反应完毕,得到Na₂FeO₄粗产品。
步骤3:配制一定量的饱和KOH溶液,取20mL加入上述三口烧瓶中,冷却结晶,减压过滤,得到K₂FeO₄粗产品。
步骤4:依次用3mol·L⁻¹KOH溶液、正戊烷、甲醇洗涤粗产品,最后置于60℃真空烘箱中干燥,得到纯度较高的K₂FeO₄产品。
回答下列问题:
(1) 根据步骤1和步骤2,写出制备高铁酸钠的化学方程式______。
(2) 实验过程中要通过冰水浴、分批加入等方式维持低温环境,目的是______。
(3) 步骤3中减压过滤装置如图,装置A的名称是______,相较于普通过滤,减压过滤的优点有______。

(4) 如何确认产品是否洗涤干净?写出必要的实验操作及现象______。
(5) 测定高铁酸钾产品纯度:取1.32g样品与过量KI溶液充分反应后配成100mL溶液,取10.00mL待测液,加入少量淀粉溶液作指示剂,用0.1000mol·L⁻¹Na₂S₂O₃标准溶液滴定,重复实验三次,消耗Na₂S₂O₃溶液平均体积为19.20mL。滴定终点现象为______,样品中高铁酸钾的质量分数为______%。(保留3位有效数字,已知:I₂ + 2S₂O₃²⁻ = 2I⁻ + S₄O₆²⁻)
答案:
17.【答案】
(1)$3NaClO + 2Fe(NO_3)_3 + 10NaOH \xlongequal{冰水浴} 2Na_2FeO_4 + 3NaCl + 6NaNO_3 + 5H_2O$(2分)
(2)减少$NaClO$、$Na_2FeO_4$等物质的分解,防止产率降低(2分)
(3)抽滤瓶(2分) 过滤速率快,过滤彻底,产品更干燥(2分)
(4)取最后一次洗涤液,加入硝酸酸化的硝酸银溶液,若不产生白色沉淀,则洗涤干净(2分)
(5)滴入最后半滴$Na_2S_2O_3$标准溶液时,溶液由蓝色变为无色,且30s内不恢复(2分) 72.0(2分)
【评分标准】
(1)反应物中写“$Fe(NO_3)_3·9H_2O$”也得分,物质正确但未配平扣1分
(3)第二空答不全得1分
(4)硝酸银溶液未用硝酸酸化不得分
(5)第二空不是3位有效数字不得分
高铁酸钾的制备过程
(1)根据步骤1和步骤2中加入的化学试剂可以推出制备高铁酸钠的化学方程式为$3NaClO + 2Fe(NO_3)_3 + 10NaOH \xlongequal{冰水浴} 2Na_2FeO_4 + 3NaCl + 6NaNO_3 + 5H_2O$。
(2)$NaClO$、$Na_2FeO_4$都是易分解的物质,故实验过程中要保持低温环境。
(3)根据减压过滤的基础知识可知A为抽滤瓶,抽滤的优点是过滤速率快,过滤彻底,产品更干燥。
(4)根据制备原理可知,除产品外还有较多的$Na^+$、$Cl^-$、$NO_3^-$,根据离子检验的现象,只需检验洗涤液中是否还有$Cl^-$即可。取最后一次洗涤液,加入硝酸酸化的硝酸银溶液,若不产生白色沉淀,则洗涤干净。
(5)根据题意可知,高铁酸钾将$I^-$氧化为$I_2$,再用$Na_2S_2O_3$滴定,故滴定终点的现象为滴入最后半滴$Na_2S_2O_3$标准溶液,溶液由蓝色变为无色,且30s内不恢复。根据氧化还原反应原理建立关系式$FeO_4^{2-} ∼ 2I_2 ∼ 4S_2O_3^{2-}$,则高铁酸钾的质量分数为$\frac{\frac{1}{4}×0.1000mol·L^{-1}×0.0192L×198g·mol^{-1}×100}{1.32g}×100\% = 72.0\%$。
(1)$3NaClO + 2Fe(NO_3)_3 + 10NaOH \xlongequal{冰水浴} 2Na_2FeO_4 + 3NaCl + 6NaNO_3 + 5H_2O$(2分)
(2)减少$NaClO$、$Na_2FeO_4$等物质的分解,防止产率降低(2分)
(3)抽滤瓶(2分) 过滤速率快,过滤彻底,产品更干燥(2分)
(4)取最后一次洗涤液,加入硝酸酸化的硝酸银溶液,若不产生白色沉淀,则洗涤干净(2分)
(5)滴入最后半滴$Na_2S_2O_3$标准溶液时,溶液由蓝色变为无色,且30s内不恢复(2分) 72.0(2分)
【评分标准】
(1)反应物中写“$Fe(NO_3)_3·9H_2O$”也得分,物质正确但未配平扣1分
(3)第二空答不全得1分
(4)硝酸银溶液未用硝酸酸化不得分
(5)第二空不是3位有效数字不得分
高铁酸钾的制备过程
(1)根据步骤1和步骤2中加入的化学试剂可以推出制备高铁酸钠的化学方程式为$3NaClO + 2Fe(NO_3)_3 + 10NaOH \xlongequal{冰水浴} 2Na_2FeO_4 + 3NaCl + 6NaNO_3 + 5H_2O$。
(2)$NaClO$、$Na_2FeO_4$都是易分解的物质,故实验过程中要保持低温环境。
(3)根据减压过滤的基础知识可知A为抽滤瓶,抽滤的优点是过滤速率快,过滤彻底,产品更干燥。
(4)根据制备原理可知,除产品外还有较多的$Na^+$、$Cl^-$、$NO_3^-$,根据离子检验的现象,只需检验洗涤液中是否还有$Cl^-$即可。取最后一次洗涤液,加入硝酸酸化的硝酸银溶液,若不产生白色沉淀,则洗涤干净。
(5)根据题意可知,高铁酸钾将$I^-$氧化为$I_2$,再用$Na_2S_2O_3$滴定,故滴定终点的现象为滴入最后半滴$Na_2S_2O_3$标准溶液,溶液由蓝色变为无色,且30s内不恢复。根据氧化还原反应原理建立关系式$FeO_4^{2-} ∼ 2I_2 ∼ 4S_2O_3^{2-}$,则高铁酸钾的质量分数为$\frac{\frac{1}{4}×0.1000mol·L^{-1}×0.0192L×198g·mol^{-1}×100}{1.32g}×100\% = 72.0\%$。
18. (15分)NO是大气污染物之一,对人类的健康和生态环境造成了严重威胁。电催化NO转化为高附加值的NH₃具有很重要的现实意义,主要反应如下。
主反应①:2NO(g) + 5H₂(g) ⇌ 2NH₃(g) + 2H₂O(g) ΔH₁
主要副反应②:2NO(g) + 2H₂(g) ⇌ N₂(g) + 2H₂O(g) ΔH₂
回答下列问题:
(1) 有关化学键键能数据如表。
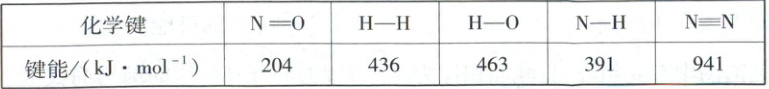
NO是比N₂更好的合成氨的氮源,请从键能的角度解释______。计算可知ΔH₁ = ______。
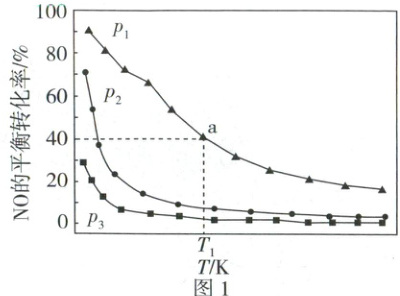
(2) 某实验小组在实验室模拟用NO合成氨反应(主反应①)。在压强分别为p₁、p₂和p₃条件下,以相同投料在不同温度下发生反应,测得NO的平衡转化率与温度的关系如图1,压强从大到小的顺序是______,原因是______。
(3) 在T₁K、p₁条件下,向一密闭容器中按n(NO):n(H₂) = 1:3投料,只发生上述主反应①,一段时间后达到平衡状态。该反应的压强平衡常数Kp = ______(写出计算式即可,平衡分压 = 气体的物质的量分数×总压)。
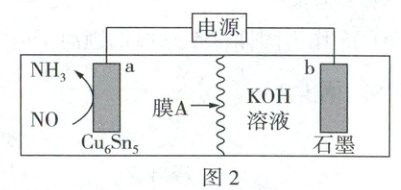
(4) 利用Cu₆Sn₅合金作催化剂电催化NO合成氨对于抑制副反应发生和提升氨产率都有很重要的战略意义,模拟装置如图2所示,写出b电极的电极反应式______。若用铅酸蓄电池作为该装置的电源,若铅酸蓄电池负极增重19.2g,则合成NH₃的体积为______L(标准状况下)。
(5) 西安交大研究团队开发了一种新型OsₓPtᵧ固体催化剂(x、y分别为Os、Pt的含量,以γ−Al₂O₃为载体),在常压、200℃条件下实现了NO到NH₃的高效转化,产率高达97%。图3为NH₃产率随Os含量变化的曲线,图4为NO、H₂在催化剂表面的吸附机理。当催化剂OsₓPtᵧ在x、y分别为______时为最佳催化效果,Os含量过高或过低都不利于NH₃达到较高产率的可能原因是______。


主反应①:2NO(g) + 5H₂(g) ⇌ 2NH₃(g) + 2H₂O(g) ΔH₁
主要副反应②:2NO(g) + 2H₂(g) ⇌ N₂(g) + 2H₂O(g) ΔH₂
回答下列问题:
(1) 有关化学键键能数据如表。

NO是比N₂更好的合成氨的氮源,请从键能的角度解释______。计算可知ΔH₁ = ______。
(2) 某实验小组在实验室模拟用NO合成氨反应(主反应①)。在压强分别为p₁、p₂和p₃条件下,以相同投料在不同温度下发生反应,测得NO的平衡转化率与温度的关系如图1,压强从大到小的顺序是______,原因是______。
(3) 在T₁K、p₁条件下,向一密闭容器中按n(NO):n(H₂) = 1:3投料,只发生上述主反应①,一段时间后达到平衡状态。该反应的压强平衡常数Kp = ______(写出计算式即可,平衡分压 = 气体的物质的量分数×总压)。
(4) 利用Cu₆Sn₅合金作催化剂电催化NO合成氨对于抑制副反应发生和提升氨产率都有很重要的战略意义,模拟装置如图2所示,写出b电极的电极反应式______。若用铅酸蓄电池作为该装置的电源,若铅酸蓄电池负极增重19.2g,则合成NH₃的体积为______L(标准状况下)。
(5) 西安交大研究团队开发了一种新型OsₓPtᵧ固体催化剂(x、y分别为Os、Pt的含量,以γ−Al₂O₃为载体),在常压、200℃条件下实现了NO到NH₃的高效转化,产率高达97%。图3为NH₃产率随Os含量变化的曲线,图4为NO、H₂在催化剂表面的吸附机理。当催化剂OsₓPtᵧ在x、y分别为______时为最佳催化效果,Os含量过高或过低都不利于NH₃达到较高产率的可能原因是______。




答案:
18.【答案】
(1)N = O键键能小于N≡N键键能,N = O键更容易断裂(1分) $-1610kJ·mol^{-1}$(1分)
(2)$p_1 > p_2 > p_3$(1分) 该反应为气体分子数减小的反应,增大压强平衡右移,NO的平衡转化率增大(2分)
(3)$\frac{(0.4)^{2}×(0.4)^{2}}{(2.0)^{5}×(0.6)^{2}p_1^{3}}$(2分)
(4)$4OH^- - 4e^- = O_2↑ + 2H_2O$(2分) 1.792(2分)
(5)0.1、0.9(2分) Os含量过高不利于H的吸附,过低不利于N的吸附(2分)
【评分标准】
(1)第一空叙述合理即可得分,第二空不带单位不得分
(2)第一空答“$p_1$、$p_2$、$p_3$”也得分
(3)其他合理答案也得分
化学反应原理
(1)从题中所给的键能数据可以看出N = O键键能小于N≡N键键能,N = O键更容易断裂,所以NO是合成氨的更佳氮源。$\Delta H =$反应物的总键能 - 生成物的总键能$=[2×204 + 5×436 - (6×391 + 4×463)]kJ·mol^{-1} = -1610kJ·mol^{-1}$。
(2)由图可知$p_1$、$p_2$、$p_3$对应的NO的平衡转化率逐渐减小,该反应为气体分子数减小的反应,增大压强平衡右移,NO的平衡转化率增大,故$p_1 > p_2 > p_3$。
(3)假设初始投料$n(NO) = 1mol$,则$n(H_2) = 3mol$,根据三段式计算:
$2NO(g) + 5H_2(g) \rightleftharpoons 2NH_3(g) + 2H_2O(g)$
初始量/mol 1 3 0 0
转化量/mol 0.4 1.0 0.4 0.4
平衡量/mol 0.6 2.0 0.4 0.4
平衡时气体总物质的量$=(0.6 + 2.0 + 0.4 + 0.4)mol = 3.4mol$,则$K_p = \frac{(\frac{0.4}{3.4}×p_1)^{2}×(\frac{0.4}{3.4}×p_1)^{2}}{(\frac{0.6}{3.4}×p_1)^{5}×(\frac{2.0}{3.4}×p_1)^{2}} = \frac{(0.4)^{2}×(0.4)^{2}}{(2.0)^{5}×(0.6)^{2}p_1^{3}}$。
(4)a电极上NO转化为$NH_3$,a电极为阴极,电极反应式为$NO + 5e^- + 4H_2O = NH_3 + 5OH^-$,b电极为阳极,石墨惰性电极上$OH^-$放电,电极反应式为$4OH^- - 4e^- = O_2↑ + 2H_2O$。铅酸蓄电池负极反应式为$Pb - 2e^- + SO_4^{2-} = PbSO_4$,增重19.2g,为0.2mol$SO_4^{2-}$,电路中有0.4mol$e^-$通过,则产生氨气为0.08mol,标准状况下$NH_3$的体积为$0.08mol×22.4L·mol^{-1} = 1.792L$。
(5)由图3分析可知,当横坐标Os含量为0.1时,$NH_3$产率达最高,故x、y分别为0.1、0.9时为最佳催化效果,由图4可知Os表面吸附NO中的N,Pt表面吸附H,从而合成$NH_3$,故Os含量过高不利于H的吸附,过低不利于N的吸附,从而使$NH_3$的产率低。
(1)N = O键键能小于N≡N键键能,N = O键更容易断裂(1分) $-1610kJ·mol^{-1}$(1分)
(2)$p_1 > p_2 > p_3$(1分) 该反应为气体分子数减小的反应,增大压强平衡右移,NO的平衡转化率增大(2分)
(3)$\frac{(0.4)^{2}×(0.4)^{2}}{(2.0)^{5}×(0.6)^{2}p_1^{3}}$(2分)
(4)$4OH^- - 4e^- = O_2↑ + 2H_2O$(2分) 1.792(2分)
(5)0.1、0.9(2分) Os含量过高不利于H的吸附,过低不利于N的吸附(2分)
【评分标准】
(1)第一空叙述合理即可得分,第二空不带单位不得分
(2)第一空答“$p_1$、$p_2$、$p_3$”也得分
(3)其他合理答案也得分
化学反应原理
(1)从题中所给的键能数据可以看出N = O键键能小于N≡N键键能,N = O键更容易断裂,所以NO是合成氨的更佳氮源。$\Delta H =$反应物的总键能 - 生成物的总键能$=[2×204 + 5×436 - (6×391 + 4×463)]kJ·mol^{-1} = -1610kJ·mol^{-1}$。
(2)由图可知$p_1$、$p_2$、$p_3$对应的NO的平衡转化率逐渐减小,该反应为气体分子数减小的反应,增大压强平衡右移,NO的平衡转化率增大,故$p_1 > p_2 > p_3$。
(3)假设初始投料$n(NO) = 1mol$,则$n(H_2) = 3mol$,根据三段式计算:
$2NO(g) + 5H_2(g) \rightleftharpoons 2NH_3(g) + 2H_2O(g)$
初始量/mol 1 3 0 0
转化量/mol 0.4 1.0 0.4 0.4
平衡量/mol 0.6 2.0 0.4 0.4
平衡时气体总物质的量$=(0.6 + 2.0 + 0.4 + 0.4)mol = 3.4mol$,则$K_p = \frac{(\frac{0.4}{3.4}×p_1)^{2}×(\frac{0.4}{3.4}×p_1)^{2}}{(\frac{0.6}{3.4}×p_1)^{5}×(\frac{2.0}{3.4}×p_1)^{2}} = \frac{(0.4)^{2}×(0.4)^{2}}{(2.0)^{5}×(0.6)^{2}p_1^{3}}$。
(4)a电极上NO转化为$NH_3$,a电极为阴极,电极反应式为$NO + 5e^- + 4H_2O = NH_3 + 5OH^-$,b电极为阳极,石墨惰性电极上$OH^-$放电,电极反应式为$4OH^- - 4e^- = O_2↑ + 2H_2O$。铅酸蓄电池负极反应式为$Pb - 2e^- + SO_4^{2-} = PbSO_4$,增重19.2g,为0.2mol$SO_4^{2-}$,电路中有0.4mol$e^-$通过,则产生氨气为0.08mol,标准状况下$NH_3$的体积为$0.08mol×22.4L·mol^{-1} = 1.792L$。
(5)由图3分析可知,当横坐标Os含量为0.1时,$NH_3$产率达最高,故x、y分别为0.1、0.9时为最佳催化效果,由图4可知Os表面吸附NO中的N,Pt表面吸附H,从而合成$NH_3$,故Os含量过高不利于H的吸附,过低不利于N的吸附,从而使$NH_3$的产率低。
查看更多完整答案,请扫码查看


