2026年高考领航卷化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年高考领航卷化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
15. 钠离子-石墨炔(GDY)电池是一种高可逆容量、长循环寿命的新型电池,其装置如图所示。石墨炔是层状结构,其层间距与Na⁺直径相仿。首周充电即电池组装完成后第一次充电过程。下列说法错误的是
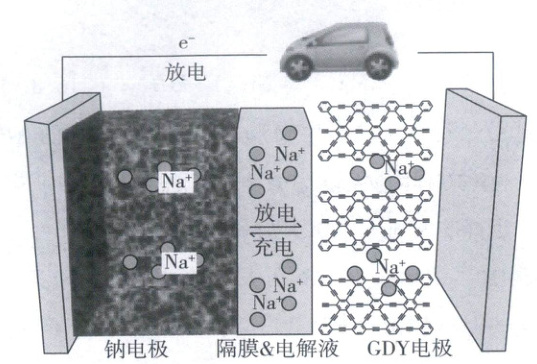
A.放电时正极电极反应式为Na⁺ + GDY + e⁻ = Na-GDY
B.GDY中sp²和sp杂化的C为其导电性提供了条件
C.GDY层间距有利于Na⁺的嵌入和沿着GDY碳平面进行传输
D.电池组装完成无需对GDY电极进行任何处理即可首周充电

A.放电时正极电极反应式为Na⁺ + GDY + e⁻ = Na-GDY
B.GDY中sp²和sp杂化的C为其导电性提供了条件
C.GDY层间距有利于Na⁺的嵌入和沿着GDY碳平面进行传输
D.电池组装完成无需对GDY电极进行任何处理即可首周充电
答案:
15.D 钠离子 - 石墨炔(GDY)电池
装置分析:该电池属于可充电电池,其工作原理如下:
|充放电|装置类型|电极|电极反应式|
| ---- | ---- | ---- | ---- |
|放电|原电池|钠电极(负极)|Na - e⁻ = Na⁺|
|放电|原电池|GDY电极(正极)|Na⁺ + GDY + e⁻ = Na - GDY|
|充电|电解池|钠电极(阴极)|Na⁺ + e⁻ = Na|
|充电|电解池|GDY电极(阳极)|Na - GDY - e⁻ = Na⁺ + GDY|
根据上述原理分析可知,A正确;石墨炔中C原子采取sp²和sp杂化,其中π电子可以自由移动,为其导电性提供了可能,B正确;GDY层间距与Na⁺直径相仿,可以容纳Na⁺,有利于Na⁺的嵌入和沿着GDY碳平面进行传输,C正确;首周充电正极材料需提供Na⁺,需使用合适钠源对正极材料进行预钠化处理,D错误。
装置分析:该电池属于可充电电池,其工作原理如下:
|充放电|装置类型|电极|电极反应式|
| ---- | ---- | ---- | ---- |
|放电|原电池|钠电极(负极)|Na - e⁻ = Na⁺|
|放电|原电池|GDY电极(正极)|Na⁺ + GDY + e⁻ = Na - GDY|
|充电|电解池|钠电极(阴极)|Na⁺ + e⁻ = Na|
|充电|电解池|GDY电极(阳极)|Na - GDY - e⁻ = Na⁺ + GDY|
根据上述原理分析可知,A正确;石墨炔中C原子采取sp²和sp杂化,其中π电子可以自由移动,为其导电性提供了可能,B正确;GDY层间距与Na⁺直径相仿,可以容纳Na⁺,有利于Na⁺的嵌入和沿着GDY碳平面进行传输,C正确;首周充电正极材料需提供Na⁺,需使用合适钠源对正极材料进行预钠化处理,D错误。
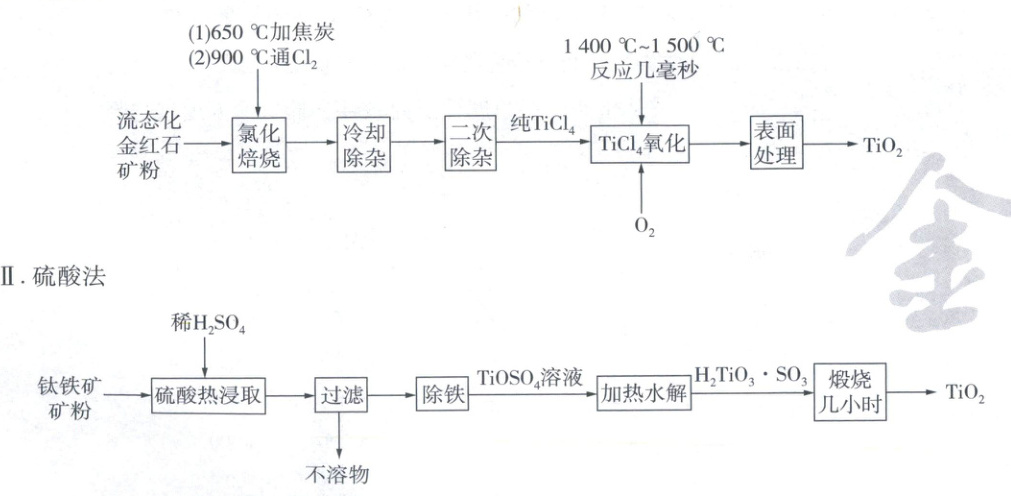
16. (14分)钛白粉(TiO₂)是一种重要化工原料,在涂料、油墨、造纸、陶瓷等工业领域有重要用途。其两种合成路线如下:
Ⅰ. 氯化法
Ⅱ. 硫酸法
已知:①天然金红石主要成分为TiO₂(90%以上),还含有Fe₂O₃、Al₂O₃和SiO₂等;
②钛铁矿主要成分是FeTiO₃,含有少量SiO₂等杂质;
③FeSO₄的溶解度随温度升高而大幅升高,TiOSO₄的溶解度受温度影响较小;
④SiCl₄、TiCl₄、AlCl₃、FeCl₃的沸点分别为58℃、136℃、181℃(升华)、316℃。
回答下列问题:
(1) Ti是22号元素,则基态Ti原子的价电子排布式为______。
(2) “氯化焙烧”过程,TiO₂参与反应的产物有两种,其中一种产物中C原子采取sp杂化,则TiO₂参与反应的化学方程式为______。
(3) “冷却除杂”可除去大多数的______(填化学式),“二次除杂”采取的操作为______。
(4) “TiCl₄氧化”的氧化产物可以返回______步骤循环使用。
(5) 硫酸法中,“除铁”过程可先加热至______,再进行冷冻处理,析出绿矾后过滤、洗涤并干燥。
(6) TiOSO₄溶液“加热水解”过程加热的目的为______。
(7) “TiCl₄氧化”过程相对于“H₂TiO₃·SO₃煅烧几小时”过程制备TiO₂的优点有______(任答一点)。
Ⅰ. 氯化法

Ⅱ. 硫酸法
已知:①天然金红石主要成分为TiO₂(90%以上),还含有Fe₂O₃、Al₂O₃和SiO₂等;
②钛铁矿主要成分是FeTiO₃,含有少量SiO₂等杂质;
③FeSO₄的溶解度随温度升高而大幅升高,TiOSO₄的溶解度受温度影响较小;
④SiCl₄、TiCl₄、AlCl₃、FeCl₃的沸点分别为58℃、136℃、181℃(升华)、316℃。
回答下列问题:
(1) Ti是22号元素,则基态Ti原子的价电子排布式为______。
(2) “氯化焙烧”过程,TiO₂参与反应的产物有两种,其中一种产物中C原子采取sp杂化,则TiO₂参与反应的化学方程式为______。
(3) “冷却除杂”可除去大多数的______(填化学式),“二次除杂”采取的操作为______。
(4) “TiCl₄氧化”的氧化产物可以返回______步骤循环使用。
(5) 硫酸法中,“除铁”过程可先加热至______,再进行冷冻处理,析出绿矾后过滤、洗涤并干燥。
(6) TiOSO₄溶液“加热水解”过程加热的目的为______。
(7) “TiCl₄氧化”过程相对于“H₂TiO₃·SO₃煅烧几小时”过程制备TiO₂的优点有______(任答一点)。
答案:
16.【答案】
(1)3d²4s²(1分)
(2)TiO₂ + 2C + 2Cl₂$\stackrel{900℃}{=\!=\!=}$TiCl₄ + 2CO(2分)
(3)AlCl₃、FeCl₃(2分) 蒸馏(2分)
(4)氯化焙烧(2分)
(5)溶液表面出现晶膜(2分)
(6)加快反应TiOSO₄ + H₂O⇌H₂TiO₃·SO₃的反应速率,使平衡正向移动,提高H₂TiO₃·SO₃的产率(2分)
(7)反应耗时短等(1分)
[评分标准]
(2)未配平扣1分
(3)第一空少1个扣1分;第二空答“精馏”也给分
(5)答“溶液表面出现一层晶膜”等合理答案即可
(6)答出关键点“平衡正向移动”得1分
流程梳理:钛白粉(TiO₂)的两种生产路线(氯化法和硫酸法)分析
(1)Ti是22号元素,位于第ⅣB族,其价电子排布式为3d²4s²。
(2)“氯化焙烧”过程C作还原剂,Cl₂作氧化剂,结合流程信息可知,还得到了TiCl₄,由于另一产物中C原子采取sp杂化,故推测该物质为CO,其反应方程式为TiO₂ + 2C + 2Cl₂$\stackrel{900℃}{=\!=\!=}$TiCl₄ + 2CO。
(3)“氯化焙烧”所得产物有SiCl₄、TiCl₄、AlCl₃和FeCl₃,AlCl₃和FeCl₃的沸点高于TiCl₄,通过冷却可先除去大多数的AlCl₃和FeCl₃,剩余的SiCl₄和TiCl₄的沸点差异较大,可以通过蒸馏的方法分离二者。
(4)TiCl₄的氧化产物为Cl₂,可以返回“氯化焙烧”步骤实现循环利用。
(5)由于FeSO₄的溶解度随温度升高变化较大,而TiOSO₄溶解度随温度变化不大,故可采取降温结晶的方法分离二者,先加热至形成FeSO₄的热饱和溶液,即形成晶膜,再冷却降温使FeSO₄·7H₂O充分析出,达到“除铁”的目的。
(6)“加热水解”从反应速率的角度分析可加快反应速率,从平衡移动角度分析加热可以促进水解反应(吸热反应)平衡正向移动。
(7)“TiCl₄氧化”过程仅需几毫秒,而“煅烧H₂TiO₃·SO₃”过程需要几个小时,且后者会产生污染性气体SO₃,考生可从时间成本等角度去评价两种流程的优缺点。

16.【答案】
(1)3d²4s²(1分)
(2)TiO₂ + 2C + 2Cl₂$\stackrel{900℃}{=\!=\!=}$TiCl₄ + 2CO(2分)
(3)AlCl₃、FeCl₃(2分) 蒸馏(2分)
(4)氯化焙烧(2分)
(5)溶液表面出现晶膜(2分)
(6)加快反应TiOSO₄ + H₂O⇌H₂TiO₃·SO₃的反应速率,使平衡正向移动,提高H₂TiO₃·SO₃的产率(2分)
(7)反应耗时短等(1分)
[评分标准]
(2)未配平扣1分
(3)第一空少1个扣1分;第二空答“精馏”也给分
(5)答“溶液表面出现一层晶膜”等合理答案即可
(6)答出关键点“平衡正向移动”得1分
流程梳理:钛白粉(TiO₂)的两种生产路线(氯化法和硫酸法)分析
(1)Ti是22号元素,位于第ⅣB族,其价电子排布式为3d²4s²。
(2)“氯化焙烧”过程C作还原剂,Cl₂作氧化剂,结合流程信息可知,还得到了TiCl₄,由于另一产物中C原子采取sp杂化,故推测该物质为CO,其反应方程式为TiO₂ + 2C + 2Cl₂$\stackrel{900℃}{=\!=\!=}$TiCl₄ + 2CO。
(3)“氯化焙烧”所得产物有SiCl₄、TiCl₄、AlCl₃和FeCl₃,AlCl₃和FeCl₃的沸点高于TiCl₄,通过冷却可先除去大多数的AlCl₃和FeCl₃,剩余的SiCl₄和TiCl₄的沸点差异较大,可以通过蒸馏的方法分离二者。
(4)TiCl₄的氧化产物为Cl₂,可以返回“氯化焙烧”步骤实现循环利用。
(5)由于FeSO₄的溶解度随温度升高变化较大,而TiOSO₄溶解度随温度变化不大,故可采取降温结晶的方法分离二者,先加热至形成FeSO₄的热饱和溶液,即形成晶膜,再冷却降温使FeSO₄·7H₂O充分析出,达到“除铁”的目的。
(6)“加热水解”从反应速率的角度分析可加快反应速率,从平衡移动角度分析加热可以促进水解反应(吸热反应)平衡正向移动。
(7)“TiCl₄氧化”过程仅需几毫秒,而“煅烧H₂TiO₃·SO₃”过程需要几个小时,且后者会产生污染性气体SO₃,考生可从时间成本等角度去评价两种流程的优缺点。

查看更多完整答案,请扫码查看


