2026年高考领航卷化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年高考领航卷化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
15.【2026届河南省青桐鸣9月联考】(15分)高铜酸钠($NaCuO_{2}$)为难溶于水的黑色固体,是一种高效的强氧化剂和功能材料前驱体,在中性或酸性环境中不稳定(生成$Cu^{2+}$和$O_{2}$),制备原理为$2Na_{2}[Cu(OH)_{4}] + NaClO = 2NaCuO_{2}\downarrow + NaCl + 2NaOH + 3H_{2}O$。回答下列问题:
(1)将$Cu(OH)_{2}$分散到5.0mol·L$^{-1}$NaOH溶液中即可得到$Na_{2}[Cu(OH)_{4}]$溶液。配制5.0mol·L$^{-1}$NaOH溶液的部分实验过程如图甲:
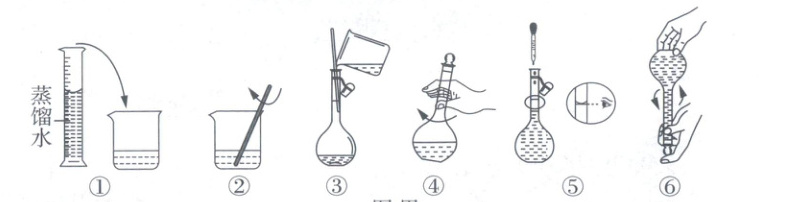
遗漏的操作a和操作b应依次放在上图的______、______(填序号)操作之后。

(2)设计如图乙装置制备NaClO溶液以及$NaCuO_{2}$。已知:温度较高时,$Cl_{2}$与NaOH溶液反应生成$NaClO_{3}$、NaCl和$H_{2}O$。
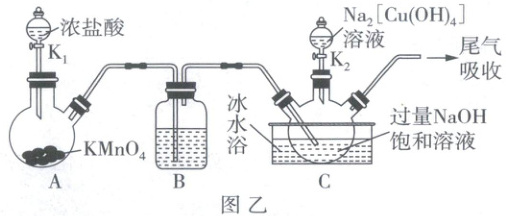
①装置A制备$Cl_{2}$的反应中,浓盐酸表现出的性质有______。
②装置B中的试剂为______;制备NaClO溶液时用冰水浴的目的主要是______。
(3)当装置C中出现大量棕黑色固体时,抽滤、用NaOH溶液洗涤、干燥得粗产品。与冰水洗涤相比,用NaOH溶液洗涤的优点是______。
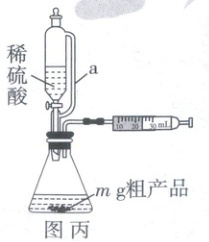
(4)测定粗产品纯度(装置如图丙):常温常压下称取m g粗产品置于锥形瓶中,通过恒压分液漏斗加入足量稀硫酸,待固体全部溶解后,立即关闭旋塞。
①装置中导管a的作用除了平衡气体压强外,还有一个作用是______。
②该装置中$NaCuO_{2}$发生反应的离子方程式为______。
③在常温常压下,反应前注射器读数为$V_{1}$mL,反应完毕后恢复到常温常压,注射器读数为$V_{2}$mL,则粗产品中$NaCuO_{2}$的纯度为______(用含m、$V_{1}$、$V_{2}$、$V_{0}$的代数式表示,设常温常压下气体摩尔体积为$V_{0}$L·mol$^{-1}$)。
(1)将$Cu(OH)_{2}$分散到5.0mol·L$^{-1}$NaOH溶液中即可得到$Na_{2}[Cu(OH)_{4}]$溶液。配制5.0mol·L$^{-1}$NaOH溶液的部分实验过程如图甲:

遗漏的操作a和操作b应依次放在上图的______、______(填序号)操作之后。

(2)设计如图乙装置制备NaClO溶液以及$NaCuO_{2}$。已知:温度较高时,$Cl_{2}$与NaOH溶液反应生成$NaClO_{3}$、NaCl和$H_{2}O$。

①装置A制备$Cl_{2}$的反应中,浓盐酸表现出的性质有______。
②装置B中的试剂为______;制备NaClO溶液时用冰水浴的目的主要是______。
(3)当装置C中出现大量棕黑色固体时,抽滤、用NaOH溶液洗涤、干燥得粗产品。与冰水洗涤相比,用NaOH溶液洗涤的优点是______。
(4)测定粗产品纯度(装置如图丙):常温常压下称取m g粗产品置于锥形瓶中,通过恒压分液漏斗加入足量稀硫酸,待固体全部溶解后,立即关闭旋塞。
①装置中导管a的作用除了平衡气体压强外,还有一个作用是______。
②该装置中$NaCuO_{2}$发生反应的离子方程式为______。
③在常温常压下,反应前注射器读数为$V_{1}$mL,反应完毕后恢复到常温常压,注射器读数为$V_{2}$mL,则粗产品中$NaCuO_{2}$的纯度为______(用含m、$V_{1}$、$V_{2}$、$V_{0}$的代数式表示,设常温常压下气体摩尔体积为$V_{0}$L·mol$^{-1}$)。

答案:
(1)③(1分) ④(1分)
(2)①还原性、酸性(2分,每个1分) ②饱和食盐水(1分) 防止副反应发生(2分)
(3)NaCuO₂在碱性条件下比较稳定,损失小(2分,答出NaCuO₂在碱性条件下比较稳定即可得分)
(4)①消除由稀硫酸体积引起的氧气体积误差(2分)
②4NaCuO₂ + 12H⁺ = 4Na⁺ + O₂↑ + 4Cu²⁺ + 6H₂O(2分,未配平得1分)
③$\frac{47.6(V₂ - V₁)}{mV₀}$%(2分)
高铜酸钠制备实验分析
(1)操作a是洗涤,应放在移液操作即操作③之后;操作b是将蒸馏水注入容量瓶,至液面离容量瓶颈部的刻度线1~2cm处,应放在操作④之后。
(2)①装置A制备Cl₂的反应为2KMnO₄ + 16HCl(浓) = 2KCl + 2MnCl₂ + 5Cl₂↑ + 8H₂O,浓盐酸变成盐和Cl₂,体现酸性和还原性。②C中反应在碱性条件下进行,装置B中的试剂应为饱和食盐水,目的是除去氯气中混有的氯化氢。由已知信息知当温度较高时,氯气与氢氧化钠溶液发生副反应生成氯酸钠、氯化钠和水,故制备NaClO溶液时用冰水浴的目的主要是防止副反应发生。
(3)由题干可知高铜酸钠(NaCuO₂)在中性或酸性环境中不稳定,在碱性条件下比较稳定,用NaOH溶液洗涤时损失小。
(4)①装置中导管a的作用是保持恒压分液漏斗内气体压强与锥形瓶内气体压强相等,打开恒压分液漏斗旋塞时稀硫酸能顺利滴下,另外,滴入锥形瓶的稀硫酸体积等于进入恒压分液漏斗的气体体积,从而消除由稀硫酸体积引起的氧气体积误差。②依题意,NaCuO₂难溶于水以及在酸性条件下生成Cu²⁺、O₂,由此可写出离子方程式。③依题意,生成O₂的物质的量为$\frac{V₂ - V₁}{V₀}$×10⁻³mol,粗产品中NaCuO₂的质量为4×$\frac{V₂ - V₁}{V₀}$×10⁻³mol×119g·mol⁻¹ = $\frac{476(V₂ - V₁)}{V₀}$×10⁻³g,则粗产品中NaCuO₂的纯度为$\frac{\frac{476(V₂ - V₁)}{V₀}×10⁻³}{m}$×100%。
(1)③(1分) ④(1分)
(2)①还原性、酸性(2分,每个1分) ②饱和食盐水(1分) 防止副反应发生(2分)
(3)NaCuO₂在碱性条件下比较稳定,损失小(2分,答出NaCuO₂在碱性条件下比较稳定即可得分)
(4)①消除由稀硫酸体积引起的氧气体积误差(2分)
②4NaCuO₂ + 12H⁺ = 4Na⁺ + O₂↑ + 4Cu²⁺ + 6H₂O(2分,未配平得1分)
③$\frac{47.6(V₂ - V₁)}{mV₀}$%(2分)
高铜酸钠制备实验分析
(1)操作a是洗涤,应放在移液操作即操作③之后;操作b是将蒸馏水注入容量瓶,至液面离容量瓶颈部的刻度线1~2cm处,应放在操作④之后。
(2)①装置A制备Cl₂的反应为2KMnO₄ + 16HCl(浓) = 2KCl + 2MnCl₂ + 5Cl₂↑ + 8H₂O,浓盐酸变成盐和Cl₂,体现酸性和还原性。②C中反应在碱性条件下进行,装置B中的试剂应为饱和食盐水,目的是除去氯气中混有的氯化氢。由已知信息知当温度较高时,氯气与氢氧化钠溶液发生副反应生成氯酸钠、氯化钠和水,故制备NaClO溶液时用冰水浴的目的主要是防止副反应发生。
(3)由题干可知高铜酸钠(NaCuO₂)在中性或酸性环境中不稳定,在碱性条件下比较稳定,用NaOH溶液洗涤时损失小。
(4)①装置中导管a的作用是保持恒压分液漏斗内气体压强与锥形瓶内气体压强相等,打开恒压分液漏斗旋塞时稀硫酸能顺利滴下,另外,滴入锥形瓶的稀硫酸体积等于进入恒压分液漏斗的气体体积,从而消除由稀硫酸体积引起的氧气体积误差。②依题意,NaCuO₂难溶于水以及在酸性条件下生成Cu²⁺、O₂,由此可写出离子方程式。③依题意,生成O₂的物质的量为$\frac{V₂ - V₁}{V₀}$×10⁻³mol,粗产品中NaCuO₂的质量为4×$\frac{V₂ - V₁}{V₀}$×10⁻³mol×119g·mol⁻¹ = $\frac{476(V₂ - V₁)}{V₀}$×10⁻³g,则粗产品中NaCuO₂的纯度为$\frac{\frac{476(V₂ - V₁)}{V₀}×10⁻³}{m}$×100%。
查看更多完整答案,请扫码查看


