2026年高考领航卷化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年高考领航卷化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
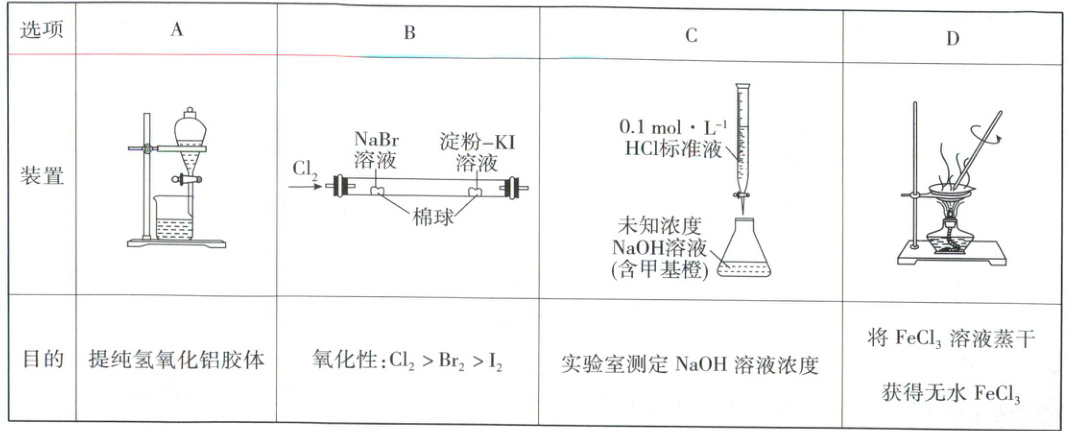
8. 下列实验装置能达到相应实验目的的是

答案:
8.C 实验装置与实验基本操作的判断 提纯胶体应用渗析的方法,A错误;$Cl_2$先与NaBr反应,使含有NaBr溶液的棉球显橙色,说明$Cl_2$的氧化性强于$Br_2$,溴易挥发,与$Cl_2$一起与含有淀粉 - KI溶液的棉球反应,使含有淀粉 - KI溶液的棉球显蓝色,无法确定是哪种物质把$I^ - $氧化为$I_2$,B错误;甲基橙作指示剂,通过中和滴定,用$0.1mol· L^{ - 1}HCl$标准液可以测定NaOH溶液浓度,C正确;$FeCl_3$易水解生成氢氧化铁和HCl,HCl易挥发,直接加热促进了$Fe^{3 + }$水解,无法获得无水$FeCl_3$,D错误。
9. X、Y、Z、W为原子序数依次增大的前四周期元素,基态原子中,X为元素周期表中半径最小的原子,Y的s能级电子数是p能级的两倍,Z是地壳中含量最多的元素,基态W原子的价电子排布式为3d¹⁰4s¹,下列说法错误的是
A.W位于ds区
B.与X形成简单化合物的沸点:Z>Y
C.X与Z形成的化合物不一定含有非极性键
D.Y₂X₄Z₂只有2种结构
A.W位于ds区
B.与X形成简单化合物的沸点:Z>Y
C.X与Z形成的化合物不一定含有非极性键
D.Y₂X₄Z₂只有2种结构
答案:
9.D 元素推断与元素周期律的应用 X、Y、Z、W为原子序数依次增大的前四周期元素,基态原子中,X为元素周期表中半径最小的原子,则X为H;Y的s能级电子数是p能级的两倍,则Y的核外电子排布式为$1s^22s^22p^2$,Y为C;Z是地壳中含量最多的元素,Z为O;W原子的价电子排布式为$3d^{10}4s^1$,W为Cu。Cu在周期表中位于第四周期第ⅠB族,属于ds区元素,A正确;$CH_4$分子间仅存在范德华力,且其相对分子质量较小,范德华力较弱,沸点较低,$H_2O$分子间存在氢键,氢键强于范德华力,因此$H_2O$的沸点高于甲烷,B正确;$H_2O$分子中不含有非极性键,C正确;$C_2H_4O_2$可以是$CH_3COOH$、$HOCH_2CHO$等,D错误。
10. 黄芩苷提取自唇形科植物黄芩的干燥根,具有抗菌、抗氧化、保护肝脏等多种生理活性。黄芩苷的结构简式如图所示,下列有关该物质的说法错误的是
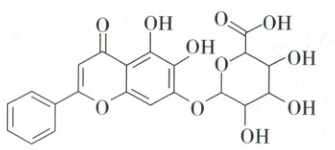
A.1mol黄芩苷分子最多能与2mol Br₂反应
B.1个黄芩苷分子中含有6个手性碳原子
C.能使溴水、酸性KMnO₄溶液褪色
D.能与NaHCO₃溶液反应放出CO₂

A.1mol黄芩苷分子最多能与2mol Br₂反应
B.1个黄芩苷分子中含有6个手性碳原子
C.能使溴水、酸性KMnO₄溶液褪色
D.能与NaHCO₃溶液反应放出CO₂
答案:
10.B 有机物的结构与性质 1mol黄芩苷分子含有1mol碳碳双键,能与1mol$Br_2$发生加成反应,黄芩苷分子中苯环上酚羟基的对位可以与$Br_2$发生取代反应,消耗1mol$Br_2$,故最多能与2mol$Br_2$反应,A正确;1个黄芩苷分子中共有5个饱和碳原子,不可能含有6个手性碳原子,B错误;碳碳双键能与溴水中的$Br_2$发生加成反应、能被酸性$KMnO_4$溶液氧化,故黄芩苷能使溴水、酸性$KMnO_4$溶液褪色,C正确;黄芩苷分子中含有羧基,能与$NaHCO_3$溶液反应放出$CO_2$,D正确。
类题通法:确定多官能团有机物性质的三步骤:
第一步 找出有机物所含的官能团,如碳碳双键、碳碳三键、醇羟基、酚羟基、醛基等
第二步 联想每种官能团的典型性质
第三步 结合选项分析对有机化合物性质描述的正误

10.B 有机物的结构与性质 1mol黄芩苷分子含有1mol碳碳双键,能与1mol$Br_2$发生加成反应,黄芩苷分子中苯环上酚羟基的对位可以与$Br_2$发生取代反应,消耗1mol$Br_2$,故最多能与2mol$Br_2$反应,A正确;1个黄芩苷分子中共有5个饱和碳原子,不可能含有6个手性碳原子,B错误;碳碳双键能与溴水中的$Br_2$发生加成反应、能被酸性$KMnO_4$溶液氧化,故黄芩苷能使溴水、酸性$KMnO_4$溶液褪色,C正确;黄芩苷分子中含有羧基,能与$NaHCO_3$溶液反应放出$CO_2$,D正确。
类题通法:确定多官能团有机物性质的三步骤:
第一步 找出有机物所含的官能团,如碳碳双键、碳碳三键、醇羟基、酚羟基、醛基等
第二步 联想每种官能团的典型性质
第三步 结合选项分析对有机化合物性质描述的正误

11. 随着控制和治理SO₂的方法不断发展和完善,很大程度上减少了煤利用过程中含硫污染物的排放,可使用玻碳电极和离子交换膜在如图所示的电化学膜反应器中电解处理含SO₂的废气。下列说法错误的是
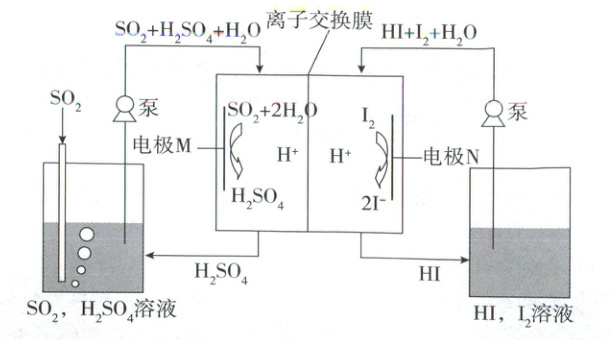
A.电极M的电极反应式为SO₂+2H₂O-2e⁻=SO₄²⁻+4H⁺
B.离子交换膜为质子交换膜,H⁺由电极N区通过交换膜移向电极M区
C.该电池中电极N区、电极M区溶液的pH均减小
D.若消耗12.7g碘单质,则理论上能处理标准状况下含1.12L SO₂的废气

A.电极M的电极反应式为SO₂+2H₂O-2e⁻=SO₄²⁻+4H⁺
B.离子交换膜为质子交换膜,H⁺由电极N区通过交换膜移向电极M区
C.该电池中电极N区、电极M区溶液的pH均减小
D.若消耗12.7g碘单质,则理论上能处理标准状况下含1.12L SO₂的废气
答案:
11.B 电化学原理 根据原理图可知,电极M上$SO_2$失电子和$H_2O$反应生成$H_2SO_4$,电极M为阳极,电极N为阴极,电极M的电极反应式为$SO_2 + 2H_2O - 2e^ - =SO_4^{2 - } + 4H^ + $,A正确;离子交换膜为质子交换膜,$H^ + $由电极M区通过离子交换膜移向电极N区,B错误;由B项分析可知,电极M区溶液的pH减小,$H^ + $通过离子交换膜转移至电极N区,则电极N区溶液的pH也减小,C正确;根据电池示意图可知,该电池的阳极电极反应式为$SO_2 + 2H_2O - 2e^ - =SO_4^{2 - } + 4H^ + $,阴极电极反应式为$I_2 + 2e^ - =2I^ - $,则电池总反应的离子方程式为$SO_2 + 2H_2O + I_2=2I^ - + SO_4^{2 - } + 4H^ + $,12.7g碘单质的物质的量为0.05mol,则消耗$SO_2$的物质的量为0.05mol,标准状况下$SO_2$的体积为1.12L,D正确。
查看更多完整答案,请扫码查看


