2026年高考领航卷化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年高考领航卷化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
18. (14分)硅是重要的半导体材料。在高温下用Zn还原SiCl₄是制取多晶硅的重要途径。涉及反应如下:
反应Ⅰ:SiCl₄(g)+2Zn(g)$\xrightleftharpoons{}$Si(s)+2ZnCl₂(g) ΔH₁=-134kJ·mol⁻¹
反应Ⅱ:SiCl₄(g)+Zn(g)$\xrightleftharpoons{}$SiCl₂(g)+ZnCl₂(g) ΔH₂
反应Ⅲ:SiCl₄(g)+Si(s)$\xrightleftharpoons{}$2SiCl₂(g) ΔH₃=+330kJ·mol⁻¹
回答下列问题:
(1)ΔH₂= kJ·mol⁻¹,反应Ⅲ在 (填"高温"或"低温")下可自发进行。
(2)在温度为1500K的刚性密闭容器中,充入1mol SiCl₄(g)和2mol Zn(g)发生上述反应。测得不同反应时间容器内的压强如表所示,平衡时ZnCl₂在气体中的物质的量分数为62.5%。
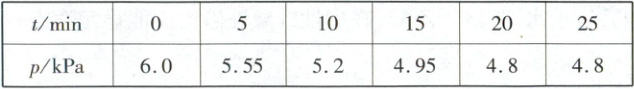
①在0~20min用SiCl₄表示的速率v(SiCl₄)= kPa·min⁻¹;该温度下反应Ⅱ的压强平衡常数K_p= 。
②平衡后,再向刚性容器中充入一定量的Zn(g),重新达到平衡后,气体分压p(ZnCl₂) (填"增大""减小"或"不变",下同),$\frac{p(SiCl_4)}{p(SiCl_2)}$将 。
(3)已知:S表示产物的选择性,S(Si)=$\frac{n(Si)}{n(Si)+n(SiCl_2)}$×100%、S(SiCl₂)=$\frac{n(SiCl_2)}{n(Si)+n(SiCl_2)}$×100%。将1mol SiCl₄(g)和2mol Zn(g)充入恒压密闭容器中进行上述反应,平衡时,SiCl₄的转化率α(SiCl₄)、Si和SiCl₂的选择性随温度的变化关系如图所示。

图中表示SiCl₂的选择性的曲线是 (填"a""b"或"c");当温度高于1220℃时,曲线c上升的原因是 。
反应Ⅰ:SiCl₄(g)+2Zn(g)$\xrightleftharpoons{}$Si(s)+2ZnCl₂(g) ΔH₁=-134kJ·mol⁻¹
反应Ⅱ:SiCl₄(g)+Zn(g)$\xrightleftharpoons{}$SiCl₂(g)+ZnCl₂(g) ΔH₂
反应Ⅲ:SiCl₄(g)+Si(s)$\xrightleftharpoons{}$2SiCl₂(g) ΔH₃=+330kJ·mol⁻¹
回答下列问题:
(1)ΔH₂= kJ·mol⁻¹,反应Ⅲ在 (填"高温"或"低温")下可自发进行。
(2)在温度为1500K的刚性密闭容器中,充入1mol SiCl₄(g)和2mol Zn(g)发生上述反应。测得不同反应时间容器内的压强如表所示,平衡时ZnCl₂在气体中的物质的量分数为62.5%。

①在0~20min用SiCl₄表示的速率v(SiCl₄)= kPa·min⁻¹;该温度下反应Ⅱ的压强平衡常数K_p= 。
②平衡后,再向刚性容器中充入一定量的Zn(g),重新达到平衡后,气体分压p(ZnCl₂) (填"增大""减小"或"不变",下同),$\frac{p(SiCl_4)}{p(SiCl_2)}$将 。
(3)已知:S表示产物的选择性,S(Si)=$\frac{n(Si)}{n(Si)+n(SiCl_2)}$×100%、S(SiCl₂)=$\frac{n(SiCl_2)}{n(Si)+n(SiCl_2)}$×100%。将1mol SiCl₄(g)和2mol Zn(g)充入恒压密闭容器中进行上述反应,平衡时,SiCl₄的转化率α(SiCl₄)、Si和SiCl₂的选择性随温度的变化关系如图所示。

图中表示SiCl₂的选择性的曲线是 (填"a""b"或"c");当温度高于1220℃时,曲线c上升的原因是 。
答案:
18.[答案]
(1)+98(2分) 高温(2分)
(2)①0.09(2分) 9(2分) ②增大(1分) 减小(1分)
(3)b(2分) 当温度高于1220℃时,升温反应Ⅰ平衡逆向移动,但反应Ⅱ、Ⅲ平衡正向移动且移动程度更大(2分)
[评分标准]
(1)第一空不写“+”也得分
(2)①第一空写$\frac{9}{100}$也得分
(3)第二空叙述合理即得分
化学反应原理的应用
(1)根据盖斯定律得反应Ⅱ=$\frac{1}{2}×$(反应Ⅰ+反应Ⅲ),则$\Delta H=\frac{330kJ· mol^{-1}-134kJ· mol^{-1}}{2}= + 98kJ· mol^{-1}$。反应Ⅲ的$\Delta H > 0$,$\Delta S > 0$,$\Delta H - T\Delta S < 0$时反应能自发进行,则反应Ⅲ需要在高温下才能自发进行。
(2)①由表格数据可知,20min时反应已达到平衡状态,反应Ⅲ = 2×反应Ⅱ - 反应Ⅰ,计算时可以不考虑反应Ⅲ。反应Ⅱ的反应前后气体分子数不变,不影响压强,故压强的变化只考虑反应Ⅰ即可。在刚性密闭容器中,气体压强之比 = 气体物质的量之比,即$3:6.0 = n(平衡气体):4.8mol$,$n(平衡气体) = 2.4mol$;平衡时$ZnCl_2$在气体中的物质的量分数为62.5%,则$n(ZnCl_2) = 2.4mol×62.5\% = 1.5mol$。利用差量法可得反应Ⅰ参加反应的$n(SiCl_4) = 0.6mol$。列式如下:
$SiCl_4(g)+2Zn(g)\rightleftharpoons Si(s)+2ZnCl_2(g)$
起始量/mol 1 2 0 0
转化量/mol 0.6 1.2 0.6 1.2
$SiCl_4(g)+Zn(g)\rightleftharpoons SiCl_2(g)+ZnCl_2(g)$
转化量/mol 0.3 0.3 0.3 0.3
平衡时,$n(ZnCl_2) = 1.5mol$,根据锌原子守恒,可得平衡时$n(Zn) = 0.5mol$,$n(SiCl_4) = 1mol - 0.6mol - 0.3mol = 0.1mol$,由反应Ⅱ可知$n(SiCl_2) = 0.3mol$。初始时$p(SiCl_4)=\frac{1}{3}×6kPa = 2kPa$,平衡时$p(SiCl_4)=\frac{0.1}{2.4}×4.8kPa = 0.2kPa$,$\Delta p(SiCl_4)=2kPa - 0.2kPa = 1.8kPa$,则$v(SiCl_4)=\frac{1.8kPa}{20min}=0.09kPa· min^{-1}$。平衡时$p(SiCl_2)=\frac{0.3}{2.4}×4.8kPa = 0.6kPa$、$p(ZnCl_2)=\frac{1.5}{2.4}×4.8kPa = 3kPa$、$p(Zn)=\frac{0.5}{2.4}×4.8kPa = 1kPa$,反应Ⅱ的压强平衡常数$K_p=\frac{p(ZnCl_2)× p(SiCl_2)}{p(SiCl_4)× p(Zn)}=\frac{3kPa×0.6kPa}{0.2kPa×1kPa}=9$。②向平衡体系中加入Zn(g),Zn与$SiCl_4$反应转变为$ZnCl_2$,则$p(ZnCl_2)$增大,$p(SiCl_4)$减小,由反应Ⅲ中$K_3=\frac{p^2(SiCl_2)}{p(SiCl_4)}$可知,温度不变,$K_3$不变,则$p(SiCl_2)$减小。$\frac{p(SiCl_2)}{p(SiCl_4)}=\frac{p(SiCl_2)· p(SiCl_4)}{p^2(SiCl_4)}=\frac{p(SiCl_2)}{K_3}$,$K_3$不变,$p(SiCl_4)$减小,则$\frac{p(SiCl_2)}{p(SiCl_4)}$减小。
(3)反应Ⅰ是放热反应,升高温度平衡逆向移动,Si的选择性减小;反应Ⅱ是吸热反应,升高温度平衡正向移动,$SiCl_2$的选择性增大,故曲线a表示Si的选择性随温度变化关系,曲线b表示$SiCl_2$的选择性随温度变化关系,曲线c表示$SiCl_4$的平衡转化率随温度变化关系;当温度高于1220℃时,升高温度反应Ⅰ平衡逆向移动,但反应Ⅱ、Ⅲ平衡正向移动且移动程度更大,导致$SiCl_4$的平衡转化率(曲线c)逐渐增大。
(1)+98(2分) 高温(2分)
(2)①0.09(2分) 9(2分) ②增大(1分) 减小(1分)
(3)b(2分) 当温度高于1220℃时,升温反应Ⅰ平衡逆向移动,但反应Ⅱ、Ⅲ平衡正向移动且移动程度更大(2分)
[评分标准]
(1)第一空不写“+”也得分
(2)①第一空写$\frac{9}{100}$也得分
(3)第二空叙述合理即得分
化学反应原理的应用
(1)根据盖斯定律得反应Ⅱ=$\frac{1}{2}×$(反应Ⅰ+反应Ⅲ),则$\Delta H=\frac{330kJ· mol^{-1}-134kJ· mol^{-1}}{2}= + 98kJ· mol^{-1}$。反应Ⅲ的$\Delta H > 0$,$\Delta S > 0$,$\Delta H - T\Delta S < 0$时反应能自发进行,则反应Ⅲ需要在高温下才能自发进行。
(2)①由表格数据可知,20min时反应已达到平衡状态,反应Ⅲ = 2×反应Ⅱ - 反应Ⅰ,计算时可以不考虑反应Ⅲ。反应Ⅱ的反应前后气体分子数不变,不影响压强,故压强的变化只考虑反应Ⅰ即可。在刚性密闭容器中,气体压强之比 = 气体物质的量之比,即$3:6.0 = n(平衡气体):4.8mol$,$n(平衡气体) = 2.4mol$;平衡时$ZnCl_2$在气体中的物质的量分数为62.5%,则$n(ZnCl_2) = 2.4mol×62.5\% = 1.5mol$。利用差量法可得反应Ⅰ参加反应的$n(SiCl_4) = 0.6mol$。列式如下:
$SiCl_4(g)+2Zn(g)\rightleftharpoons Si(s)+2ZnCl_2(g)$
起始量/mol 1 2 0 0
转化量/mol 0.6 1.2 0.6 1.2
$SiCl_4(g)+Zn(g)\rightleftharpoons SiCl_2(g)+ZnCl_2(g)$
转化量/mol 0.3 0.3 0.3 0.3
平衡时,$n(ZnCl_2) = 1.5mol$,根据锌原子守恒,可得平衡时$n(Zn) = 0.5mol$,$n(SiCl_4) = 1mol - 0.6mol - 0.3mol = 0.1mol$,由反应Ⅱ可知$n(SiCl_2) = 0.3mol$。初始时$p(SiCl_4)=\frac{1}{3}×6kPa = 2kPa$,平衡时$p(SiCl_4)=\frac{0.1}{2.4}×4.8kPa = 0.2kPa$,$\Delta p(SiCl_4)=2kPa - 0.2kPa = 1.8kPa$,则$v(SiCl_4)=\frac{1.8kPa}{20min}=0.09kPa· min^{-1}$。平衡时$p(SiCl_2)=\frac{0.3}{2.4}×4.8kPa = 0.6kPa$、$p(ZnCl_2)=\frac{1.5}{2.4}×4.8kPa = 3kPa$、$p(Zn)=\frac{0.5}{2.4}×4.8kPa = 1kPa$,反应Ⅱ的压强平衡常数$K_p=\frac{p(ZnCl_2)× p(SiCl_2)}{p(SiCl_4)× p(Zn)}=\frac{3kPa×0.6kPa}{0.2kPa×1kPa}=9$。②向平衡体系中加入Zn(g),Zn与$SiCl_4$反应转变为$ZnCl_2$,则$p(ZnCl_2)$增大,$p(SiCl_4)$减小,由反应Ⅲ中$K_3=\frac{p^2(SiCl_2)}{p(SiCl_4)}$可知,温度不变,$K_3$不变,则$p(SiCl_2)$减小。$\frac{p(SiCl_2)}{p(SiCl_4)}=\frac{p(SiCl_2)· p(SiCl_4)}{p^2(SiCl_4)}=\frac{p(SiCl_2)}{K_3}$,$K_3$不变,$p(SiCl_4)$减小,则$\frac{p(SiCl_2)}{p(SiCl_4)}$减小。
(3)反应Ⅰ是放热反应,升高温度平衡逆向移动,Si的选择性减小;反应Ⅱ是吸热反应,升高温度平衡正向移动,$SiCl_2$的选择性增大,故曲线a表示Si的选择性随温度变化关系,曲线b表示$SiCl_2$的选择性随温度变化关系,曲线c表示$SiCl_4$的平衡转化率随温度变化关系;当温度高于1220℃时,升高温度反应Ⅰ平衡逆向移动,但反应Ⅱ、Ⅲ平衡正向移动且移动程度更大,导致$SiCl_4$的平衡转化率(曲线c)逐渐增大。
查看更多完整答案,请扫码查看


