2026年高考领航卷化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年高考领航卷化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
12. 盘状双层胶束可用于模拟生物膜,研究膜蛋白与脂双层膜的相互作用。向DMPE(其结构如图1,可视作二元酸H₂A⁺)中加入缓冲液,振荡过夜,可制得盘状双层胶束(如图2),每个盘状双层胶束约有1000个DMPE。已知:25℃时,DMPE的Ka₁ = 0.1,Ka₂ = 1×10⁻⁹;δ(H₂A⁺) = n(H₂A⁺)/[n(HA) + n(A⁻) + n(H₂A⁺)]。下列有关说法错误的是
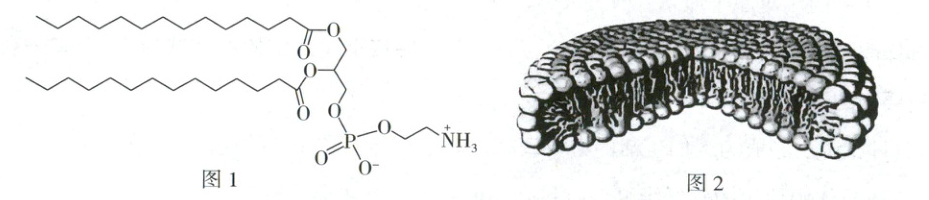
A.DMPE形成盘状双层胶束的过程与肥皂除油污的机理具有相似性
B.在强酸或强碱条件下,DMPE可能因发生水解反应而失去成胶束的功效
C.胶束所带电性与pH有关,pH = 7.0时此胶束几乎不带电
D.缓冲液是维持盘状双层胶束呈扁平状的关键,pH可能使胶束呈球状分布

A.DMPE形成盘状双层胶束的过程与肥皂除油污的机理具有相似性
B.在强酸或强碱条件下,DMPE可能因发生水解反应而失去成胶束的功效
C.胶束所带电性与pH有关,pH = 7.0时此胶束几乎不带电
D.缓冲液是维持盘状双层胶束呈扁平状的关键,pH可能使胶束呈球状分布
答案:
12.C 超分子 根据教材中超分子自组装的定义,结合题干信息可知DMPE形成盘状双层胶束的过程体现了超分子的自组装,肥皂除油污过程也体现了超分子的自组装,A正确;DMPE中含有酯基,在强酸或强碱条件下可发生水解反应,失去成为胶束的功效,B正确;DMPE可视作二元酸$H_2A^+$,每个盘状双层胶束约有1000个DMPE,带电粒子有$H_2A^+$、$A^-$,若胶束不带电呈中性,则$n(H_2A^+)=n(A^-)$,$c^2(H^+)=K_{a1}·K_{a2}=1×10^{-10}$,可知$c(H^+)=1×10^{-5}mol·L^{-1}$,pH = 5.0,C错误;胶束所带电性与pH有关,随着pH变大,胶束由正电性转变为负电性,而电荷量增大,斥力增大,胶束会形成球状以减小斥力,D正确。
13. 丙酰胺(CH₃CH₂CONH₂)是一种用于合成抗菌和抗癌药物的重要中间体,电化学合成丙酰胺的原理如图,两极产物发生C−N偶联反应最终生成丙酰胺:*NH₂OH + CH₃CH₂CHO → 丙醛肟 → 丙酰胺(*表示吸附态)。下列有关说法错误的是
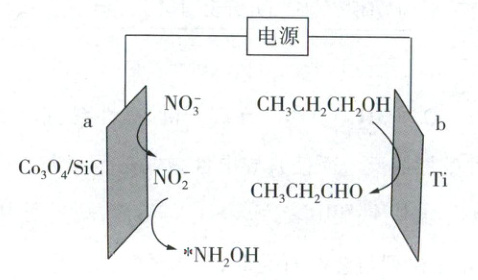
A.a极连接外接电源的负极,电极反应为NO₃⁻ + 2e⁻ + H₂O = NO₂⁻ + 2OH⁻
B.Co₃O₄/SiC为a极的催化剂,*NH₂OH为合成丙酰胺的中间产物
C.该研究的最大挑战在于阴阳极所需电子不对等,能源利用效率待提高
D.随着合成反应的进行,电解质溶液pH增大

A.a极连接外接电源的负极,电极反应为NO₃⁻ + 2e⁻ + H₂O = NO₂⁻ + 2OH⁻
B.Co₃O₄/SiC为a极的催化剂,*NH₂OH为合成丙酰胺的中间产物
C.该研究的最大挑战在于阴阳极所需电子不对等,能源利用效率待提高
D.随着合成反应的进行,电解质溶液pH增大
答案:
13.A 电化学
装置分析
b极上醇被氧化为醛,发生氧化反应,是阳极
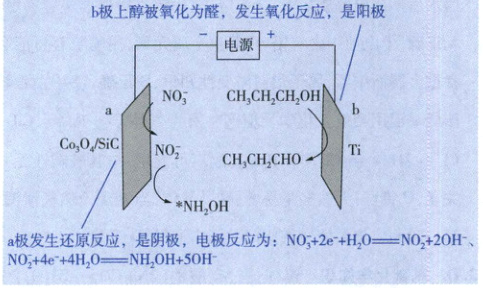
a极发生还原反应,是阴极,电极反应为:$NO_3^- + 2e^- + H_2O = NO_2^- + 2OH^-$、$NO_2^- + 4e^- + 4H_2O = NH_2OH + 5OH^-$,A错误;由题意分析可知,$Co_3O_4/SiC$为a极的催化剂,$NH_2OH$先生成后消耗,为合成丙酰胺的中间产物,B正确;b极是阳极,其电极反应为$CH_3CH_2CH_2OH - 2e^- = CH_3CH_2CHO + 2H^+$,可知两极反应物$NO_3^-$与$CH_3CH_2CH_2OH$理论消耗量之比为1:1,转移电子数之比为3:1,故阴阳极所需电子不对等,能源利用效率待提高,C正确;对比两极反应,当电路中两极转移相同数目的电子时,阴极产生的$OH^-$多于阳极产生的$H^+$,故电解质溶液pH增大,D正确。
13.A 电化学
装置分析
b极上醇被氧化为醛,发生氧化反应,是阳极

a极发生还原反应,是阴极,电极反应为:$NO_3^- + 2e^- + H_2O = NO_2^- + 2OH^-$、$NO_2^- + 4e^- + 4H_2O = NH_2OH + 5OH^-$,A错误;由题意分析可知,$Co_3O_4/SiC$为a极的催化剂,$NH_2OH$先生成后消耗,为合成丙酰胺的中间产物,B正确;b极是阳极,其电极反应为$CH_3CH_2CH_2OH - 2e^- = CH_3CH_2CHO + 2H^+$,可知两极反应物$NO_3^-$与$CH_3CH_2CH_2OH$理论消耗量之比为1:1,转移电子数之比为3:1,故阴阳极所需电子不对等,能源利用效率待提高,C正确;对比两极反应,当电路中两极转移相同数目的电子时,阴极产生的$OH^-$多于阳极产生的$H^+$,故电解质溶液pH增大,D正确。
查看更多完整答案,请扫码查看


