2026年高考领航卷化学
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2026年高考领航卷化学 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
6. 有机物M、N为巴比妥类催眠药,与解热镇痛药合用时能增强后者的镇痛作用。下列有关M、N的说法正确的是
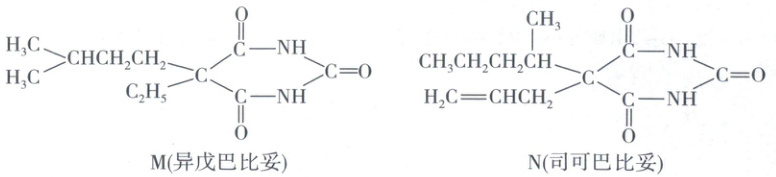
A.M和N互为同系物
B.M和N分子中都含有一个手性碳原子
C.1 mol N在足量NaOH溶液中完全水解得到两种有机物
D.M中sp²杂化与sp³杂化的碳原子数之比为3:8

A.M和N互为同系物
B.M和N分子中都含有一个手性碳原子
C.1 mol N在足量NaOH溶液中完全水解得到两种有机物
D.M中sp²杂化与sp³杂化的碳原子数之比为3:8
答案:
6.D 有机物的结构与性质
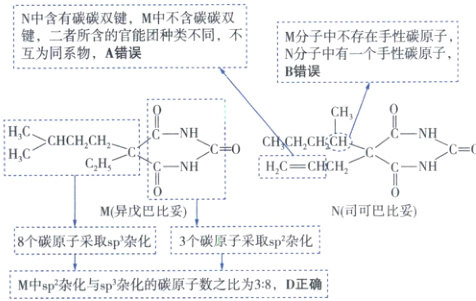
N中含有碳碳双键,M中不含碳碳双键,二者所含的官能团种类不同,不互为同系物,A错误;M分子中不存在手性碳原子,N分子中有一个手性碳原子,B错误;M中sp²杂化与sp³杂化的碳原子数之比为3:8,D正确;1molN在足量的NaOH溶液中完全水解得到1mol 、2molNH₃和1mol碳酸钠,只得到一种有机物,C错误。
、2molNH₃和1mol碳酸钠,只得到一种有机物,C错误。
6.D 有机物的结构与性质

N中含有碳碳双键,M中不含碳碳双键,二者所含的官能团种类不同,不互为同系物,A错误;M分子中不存在手性碳原子,N分子中有一个手性碳原子,B错误;M中sp²杂化与sp³杂化的碳原子数之比为3:8,D正确;1molN在足量的NaOH溶液中完全水解得到1mol
 、2molNH₃和1mol碳酸钠,只得到一种有机物,C错误。
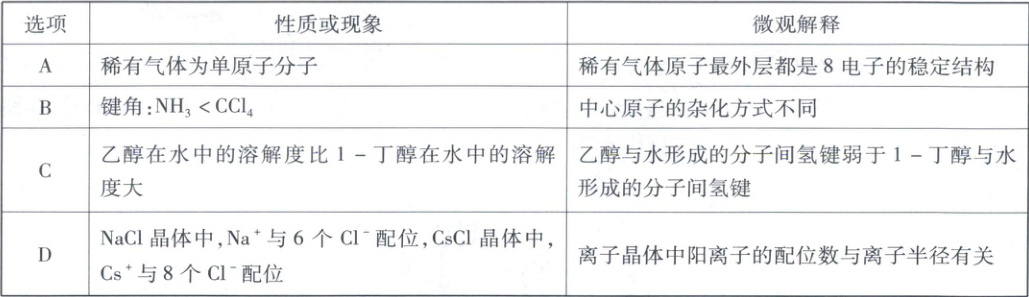
、2molNH₃和1mol碳酸钠,只得到一种有机物,C错误。 7. 下列性质或现象与微观解释相符的是

答案:
7.D物质结构与性质稀有气体原子最外层是2电子或8电子的稳定结构,故稀有气体为单原子分子,A错误;NH₃的中心原子N的孤电子对数为$\frac{1}{2}$×(5−1×3)=1,价层电子对数为4,中心原子的杂化方式为sp³,CCl₄的中心原子C的价层电子对数为4+$\frac{1}{2}$×(4−4×1)=4,孤电子对数为0,中心原子的杂化方式为sp³,二者中心原子的杂化方式相同,NH₃的键角小于CCl₄的键角是因为NH₃中N原子上含有孤电子对,而CCl₄的中心原子C上没有孤电子对,孤电子对对成键电子对的排斥作用大于成键电子对之间的排斥作用,B错误;1−丁醇溶解度小于乙醇,是因为1−丁醇中的烃基更长,疏水性更强,C错误;离子晶体中阳离子的配位数与离子半径有关,Cs⁺半径大于Na⁺半径,故Cs⁺与8个Cl⁻配位,Na⁺与6个Cl⁻配位,D正确。
8. X、Y、Z、W、Q为原子序数依次增大的短周期主族元素。基态X原子的核外电子只有一种自旋方向,这五种元素中只有Y、Z、W位于同一周期且相邻,Q的质子数为X、Y、Z、W的质子数之和的一半。下列说法正确的是
A.简单离子半径:Z > W > Q
B.电负性:X < Y < W < Z
C.W、Q形成的化合物中只含离子键
D.Y、Z、Q最高价氧化物的水化物之间能相互反应
A.简单离子半径:Z > W > Q
B.电负性:X < Y < W < Z
C.W、Q形成的化合物中只含离子键
D.Y、Z、Q最高价氧化物的水化物之间能相互反应
答案:
8.A 元素推断和物质结构
元素辨析

基态X原子的核外电子只有一种自旋方向,X为H;Q的质子数为X、Y、Z、W的质子数之和的一半,Y、Z、W、Q分别为C、N、O、Na;Y、Z、W位于第二周期,Q位于第三周期;这五种元素中只有Y、Z、W位于同一周期且相邻。具有相同核外电子排布的离子,原子序数小的半径大,简单离子半径:Z(N³⁻)>W(O²⁻)>Q(Na⁺),A正确。一般来说,元素的非金属性越强,电负性越大,电负性:X(H)<Y(C)<Z(N)<W(O),B错误。W(O)、Q(Na)能形成Na₂O₂,含有离子键和共价键,C错误。Y(C)最高价氧化物的水化物为H₂CO₃,Z(N)最高价氧化物的水化物为HNO₃,H₂CO₃和HNO₃不反应,D错误。
8.A 元素推断和物质结构
元素辨析

基态X原子的核外电子只有一种自旋方向,X为H;Q的质子数为X、Y、Z、W的质子数之和的一半,Y、Z、W、Q分别为C、N、O、Na;Y、Z、W位于第二周期,Q位于第三周期;这五种元素中只有Y、Z、W位于同一周期且相邻。具有相同核外电子排布的离子,原子序数小的半径大,简单离子半径:Z(N³⁻)>W(O²⁻)>Q(Na⁺),A正确。一般来说,元素的非金属性越强,电负性越大,电负性:X(H)<Y(C)<Z(N)<W(O),B错误。W(O)、Q(Na)能形成Na₂O₂,含有离子键和共价键,C错误。Y(C)最高价氧化物的水化物为H₂CO₃,Z(N)最高价氧化物的水化物为HNO₃,H₂CO₃和HNO₃不反应,D错误。
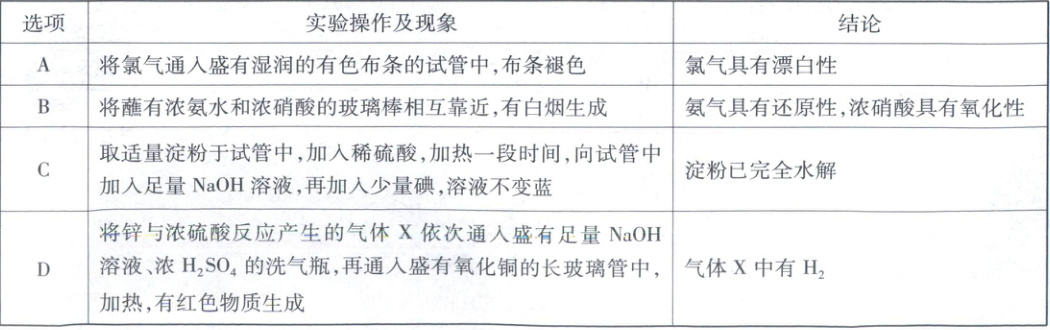
9. 下列实验操作及现象能得出相应结论的是

答案:
9.D 实验操作及现象、结论氯气没有漂白性,氯气与水反应生成的次氯酸使有色布条褪色,A错误;将蘸有浓氨水和浓硝酸的玻璃棒相互靠近,生成固体硝酸铵(不是氧化还原反应),不能说明氨气具有还原性,浓硝酸具有氧化性,B错误;向加入足量NaOH溶液的淀粉水解液中加入少量碘,碘能与过量的NaOH反应,溶液不变蓝不能说明淀粉已完全水解,C错误;锌与浓硫酸反应产生二氧化硫气体,随反应进行,浓硫酸变稀,锌与稀硫酸反应生成氢气,D正确。
查看更多完整答案,请扫码查看


