第39页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
11. 某化学兴趣小组的同学对过氧化氢分解进行探究。
【探究一】影响过氧化氢分解快慢的因素
某小组同学设计并进行实验,探究影响过氧化氢分解速率的因素。(实验装置如图1所示,夹持仪器已略去)

【猜想与假设】影响过氧化氢分解速率的因素可能有温度、溶液的浓度、催化剂种类。
【实验记录】同学们进行6组实验,实验记录如下:
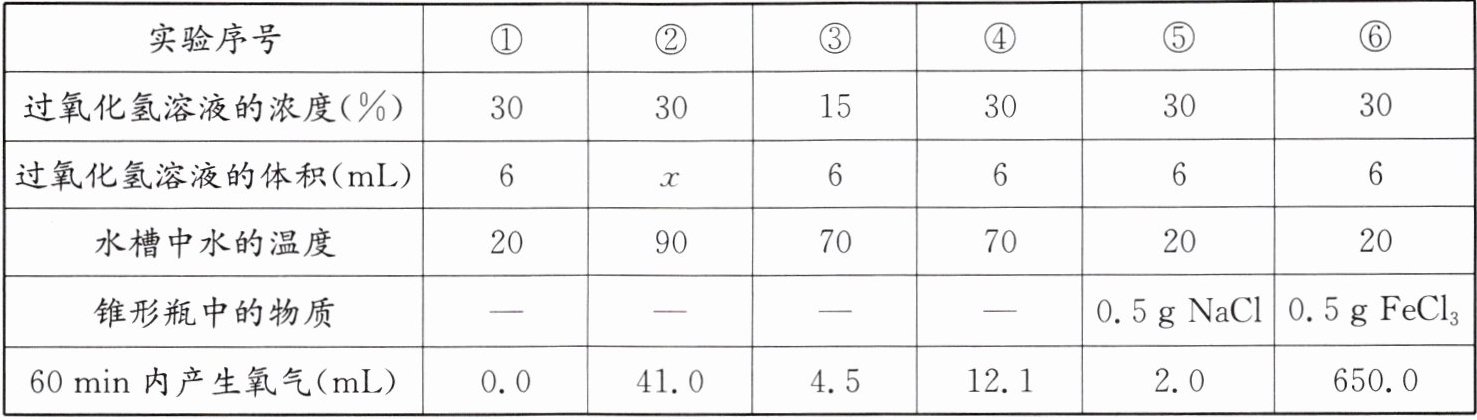
【解释与结论】
(1) 实验②中应加入过氧化氢溶液的体积$x$是
(2) 实验①~⑥通过测定相同时间内产生氧气的体积来比较过氧化氢的分解速率,还可以测定
(3) 写出实验⑥发生反应的符号表达式:
(4) 通过实验①、②、④可得出的结论是
【反思与评价】
(5) 同学们认为实验室制氧气,应选择实验⑥而不选实验②的理由是
【探究二】
硫酸铜溶液也能作过氧化氢分解反应的催化剂,小组同学在常温下,向a、b、c三个试管中分别加入等量的5%的过氧化氢溶液,在其他条件相同时,各滴入2滴5%、10%、20%的硫酸铜溶液,绘制了产生氧气的体积和时间变化的曲线如图。
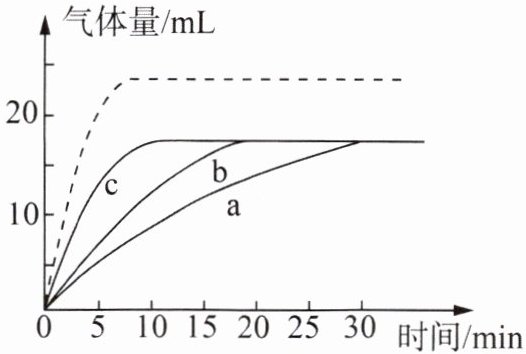
(6) 若实验中所得的曲线如图中虚线所示,请推测其中可能的原因:
【探究一】影响过氧化氢分解快慢的因素
某小组同学设计并进行实验,探究影响过氧化氢分解速率的因素。(实验装置如图1所示,夹持仪器已略去)

【猜想与假设】影响过氧化氢分解速率的因素可能有温度、溶液的浓度、催化剂种类。
【实验记录】同学们进行6组实验,实验记录如下:

【解释与结论】
(1) 实验②中应加入过氧化氢溶液的体积$x$是
6
mL。(2) 实验①~⑥通过测定相同时间内产生氧气的体积来比较过氧化氢的分解速率,还可以测定
收集等体积的氧气时所需的时间
来比较过氧化氢的分解速率。(3) 写出实验⑥发生反应的符号表达式:
$H_{2}O_{2} \stackrel{FeCl_{3}}{→}H_{2}O+O_{2}$
。(4) 通过实验①、②、④可得出的结论是
相同条件下,温度越高,过氧化氢的分解速率越快
。【反思与评价】
(5) 同学们认为实验室制氧气,应选择实验⑥而不选实验②的理由是
相同时间内实验②产生氧气少(或需要加热,水蒸气含量高,误差大)
。【探究二】
硫酸铜溶液也能作过氧化氢分解反应的催化剂,小组同学在常温下,向a、b、c三个试管中分别加入等量的5%的过氧化氢溶液,在其他条件相同时,各滴入2滴5%、10%、20%的硫酸铜溶液,绘制了产生氧气的体积和时间变化的曲线如图。

(6) 若实验中所得的曲线如图中虚线所示,请推测其中可能的原因:
过氧化氢溶液浓度大于5%(合理即可)
。
答案:
11.
(1)6
(2)收集等体积的氧气时所需的时间
(3)$H_{2}O_{2} \stackrel{FeCl_{3}}{→}H_{2}O+O_{2}$
(4)相同条件下,温度越高,过氧化氢的分解速率越快
(5)相同时间内实验②产生氧气少(或需要加热,水蒸气含量高,误差大)
(6)过氧化氢溶液浓度大于5%(合理即可)
(1)6
(2)收集等体积的氧气时所需的时间
(3)$H_{2}O_{2} \stackrel{FeCl_{3}}{→}H_{2}O+O_{2}$
(4)相同条件下,温度越高,过氧化氢的分解速率越快
(5)相同时间内实验②产生氧气少(或需要加热,水蒸气含量高,误差大)
(6)过氧化氢溶液浓度大于5%(合理即可)
查看更多完整答案,请扫码查看


