2025年启东中学作业本九年级化学上册人教版安徽专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年启东中学作业本九年级化学上册人教版安徽专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第82页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
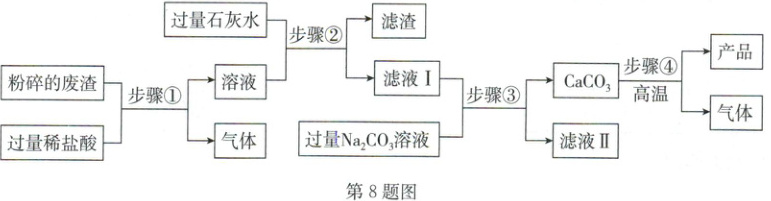
8. (2025·河北)高纯氧化钙是一种重要的化工原料。如图所示为小组同学以某工厂废渣(主要成分为 $ CaCO_3 $,含少量 $ Fe_2O_3 $ 和 $ MgCO_3 $)为原料,在实验室制备高纯氧化钙的实验方案。
请回答下列问题:
(1)氧化钙的化学式为
(2)将废渣粉碎为细小颗粒的目的是
(3)步骤②中过滤时玻璃棒的作用是
(4)步骤③中反应的化学方程式为
(5)以相同质量的废渣为原料,仅将步骤②中的石灰水换为氢氧化钠溶液,会使产品的产量
请回答下列问题:
(1)氧化钙的化学式为
CaO
。(2)将废渣粉碎为细小颗粒的目的是
增大反应物之间的接触面积,使反应更快更充分
。(3)步骤②中过滤时玻璃棒的作用是
引流
。(4)步骤③中反应的化学方程式为
Ca(OH)₂ + Na₂CO₃=CaCO₃↓ +2NaOH(或CaCl₂ + Na₂CO₃=CaCO₃↓ +2NaCl)
(写一个即可)。(5)以相同质量的废渣为原料,仅将步骤②中的石灰水换为氢氧化钠溶液,会使产品的产量
降低
(填“提高”“不变”或“降低”)。
答案:
8.
(1)CaO
(2)增大反应物之间的接触面积,使反应更快更充分
(3)引流
(4)Ca(OH)₂ + Na₂CO₃=CaCO₃↓ +2NaOH(或CaCl₂ + Na₂CO₃=CaCO₃↓ +2NaCl)
(5)降低
点拨:
(5)石灰水与氯化铁反应生成氢氧化铁沉淀和氯化钙,石灰水与氯化镁反应生成氢氧化镁沉淀和氯化钙,氯化钙和碳酸钠反应生成碳酸钙沉淀,而氢氧化钠溶液与氯化铁反应生成氢氧化铁沉淀和氯化钠,与氯化镁反应生成氢氧化镁沉淀和氯化钠,加入的石灰水中的氢氧化钙转化为碳酸钙沉淀,所以以相同质量的废渣为原料,仅将步骤②中的石灰水换为氢氧化钠溶液,会使产品的产量降低。
(1)CaO
(2)增大反应物之间的接触面积,使反应更快更充分
(3)引流
(4)Ca(OH)₂ + Na₂CO₃=CaCO₃↓ +2NaOH(或CaCl₂ + Na₂CO₃=CaCO₃↓ +2NaCl)
(5)降低
点拨:
(5)石灰水与氯化铁反应生成氢氧化铁沉淀和氯化钙,石灰水与氯化镁反应生成氢氧化镁沉淀和氯化钙,氯化钙和碳酸钠反应生成碳酸钙沉淀,而氢氧化钠溶液与氯化铁反应生成氢氧化铁沉淀和氯化钠,与氯化镁反应生成氢氧化镁沉淀和氯化钠,加入的石灰水中的氢氧化钙转化为碳酸钙沉淀,所以以相同质量的废渣为原料,仅将步骤②中的石灰水换为氢氧化钠溶液,会使产品的产量降低。
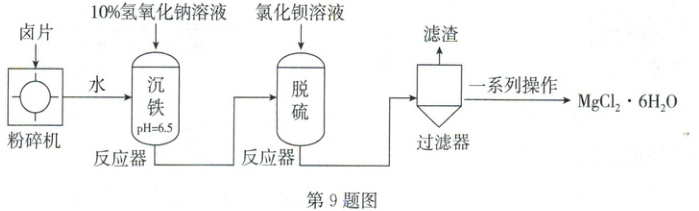
9. (2025·武汉)氯化镁产品大多数是黄褐色或白色固体,习惯称为卤片。某卤片的主要成分为 $ MgCl_2 $,还含少量 $ MgSO_4 $、$ NaCl $ 和 $ FeCl_3 $,以该卤片为原料生产 $ MgCl_2 · 6H_2O $ 的工艺流程示意图如下所示。
已知:①$ MgCl_2 · 6H_2O \xrightarrow{96 \sim 117^{\circ}C} MgCl_2 · 4H_2O \xrightarrow{135 \sim 180^{\circ}C} MgCl_2 · 2H_2O $。
②$ pH = 1.5 $ 时,氢氧化铁开始沉淀;$ pH = 2.8 $ 时,氢氧化铁沉淀完全。
③$ pH = 8.9 $ 时,氢氧化镁开始沉淀;$ pH = 10.9 $ 时,氢氧化镁沉淀完全。
(1)“沉铁”时,调节溶液 $ pH = 6.5 $,该溶液呈
(2)加入适量氯化钡溶液可实现“脱硫”,反应的化学方程式为
(3)“滤渣”的成分为
(4)为制备 $ MgCl_2 · 6H_2O $,“一系列操作”中宜采用降温结晶,而不宜采用蒸发结晶,其原因是
已知:①$ MgCl_2 · 6H_2O \xrightarrow{96 \sim 117^{\circ}C} MgCl_2 · 4H_2O \xrightarrow{135 \sim 180^{\circ}C} MgCl_2 · 2H_2O $。
②$ pH = 1.5 $ 时,氢氧化铁开始沉淀;$ pH = 2.8 $ 时,氢氧化铁沉淀完全。
③$ pH = 8.9 $ 时,氢氧化镁开始沉淀;$ pH = 10.9 $ 时,氢氧化镁沉淀完全。
(1)“沉铁”时,调节溶液 $ pH = 6.5 $,该溶液呈
酸
性。(2)加入适量氯化钡溶液可实现“脱硫”,反应的化学方程式为
BaCl₂ + MgSO₄ = BaSO₄↓ + MgCl₂
。(3)“滤渣”的成分为
氢氧化铁、硫酸钡
。(4)为制备 $ MgCl_2 · 6H_2O $,“一系列操作”中宜采用降温结晶,而不宜采用蒸发结晶,其原因是
温度较高时,MgCl₂·6H₂O易分解;蒸发结晶易导致溶液中含有的杂质NaCl析出(合理即可)
(答两点)。
答案:
9.
(1)酸
(2)BaCl₂ + MgSO₄ = BaSO₄↓ + MgCl₂
(3)氢氧化铁、硫酸钡
(4)温度较高时,MgCl₂·6H₂O易分解;蒸发结晶易导致溶液中含有的杂质NaCl析出(合理即可)
(1)酸
(2)BaCl₂ + MgSO₄ = BaSO₄↓ + MgCl₂
(3)氢氧化铁、硫酸钡
(4)温度较高时,MgCl₂·6H₂O易分解;蒸发结晶易导致溶液中含有的杂质NaCl析出(合理即可)
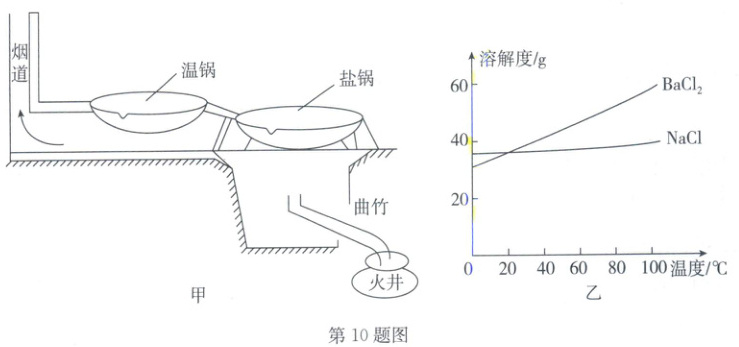
10. (2025·湖北)抗日战争时期,范旭东创办的黄海化学工业研究社(以下简称“黄海社”)西迁至四川,积极开展盐业研究。黄海社了解到当地存在一种困扰人民多年、病因未明的痹病,该社秉持“在原则上绝对地相信科学,在精神上以能服务社会为最大光荣”的理念,研究确认痹病是由当地人食用含 $ BaCl_2 $ 的井盐中毒引起。
在井盐生产中如何除去 $ BaCl_2 $?某学习小组循着黄海社足迹,开展了如下探究。
查阅资料:
①$ BaSO_4 $,白色固体,不溶于水,也不溶于盐酸。
②$ BaCO_3 $,白色固体,不溶于水,溶于盐酸。
③$ BaCl_2 $ 是重要的工业原料。
任务一:用“沉淀法”除去 $ NaCl $ 中的 $ BaCl_2 $
黄海社提出了芒硝(含 $ Na_2SO_4 $)沉淀法:$ BaCl_2 + Na_2SO_4 = BaSO_4 \downarrow + 2NaCl $。
在卤水(盐水)中加入适量芒硝,搅拌均匀,静置沉降。
(1)该法在除去 $ BaCl_2 $ 的同时,$ NaCl $ 产量
(2)有同学提出用 $ Na_2CO_3 $ 代替芒硝也可除去 $ BaCl_2 $,理由是
(3)当时痹病患者的一种解毒措施是口服 $ Na_2SO_4 $ 溶液。若服用 $ Na_2CO_3 $ 溶液则不能解毒,原因是
任务二:用“结晶法”分离 $ NaCl $ 和 $ BaCl_2 $
黄海社提出了如下方案:
备锅二口,注入卤水,烧至沸热,待盐锅中氯化钠饱和析出,捞出放入温锅中再洗,捞出沥干;随时用温锅的卤水补充至盐锅,温锅中也随时补充新卤水,保持两锅卤水体积不变,如此循环操作。
(4)循环若干次后,盐锅卤水中的 $ BaCl_2 $ 达到饱和。依据图乙,经过
(5)从能量的角度看,安装温锅的作用是
(6)盐锅中捞出的 $ NaCl $ 晶体放入温锅中洗涤,而不直接使用水洗涤,其目的是:
①减少 $ NaCl $ 溶解损失;②
在井盐生产中如何除去 $ BaCl_2 $?某学习小组循着黄海社足迹,开展了如下探究。
查阅资料:
①$ BaSO_4 $,白色固体,不溶于水,也不溶于盐酸。
②$ BaCO_3 $,白色固体,不溶于水,溶于盐酸。
③$ BaCl_2 $ 是重要的工业原料。
任务一:用“沉淀法”除去 $ NaCl $ 中的 $ BaCl_2 $
黄海社提出了芒硝(含 $ Na_2SO_4 $)沉淀法:$ BaCl_2 + Na_2SO_4 = BaSO_4 \downarrow + 2NaCl $。
在卤水(盐水)中加入适量芒硝,搅拌均匀,静置沉降。
(1)该法在除去 $ BaCl_2 $ 的同时,$ NaCl $ 产量
增大
(填“增大”或“减小”)。(2)有同学提出用 $ Na_2CO_3 $ 代替芒硝也可除去 $ BaCl_2 $,理由是
BaCl₂ + Na₂CO₃=BaCO₃↓ +2NaCl
(用化学方程式表示)。(3)当时痹病患者的一种解毒措施是口服 $ Na_2SO_4 $ 溶液。若服用 $ Na_2CO_3 $ 溶液则不能解毒,原因是
碳酸钠和氯化钡反应生成的碳酸钡能和胃液中的盐酸反应生成氯化钡、水和二氧化碳
。任务二:用“结晶法”分离 $ NaCl $ 和 $ BaCl_2 $
黄海社提出了如下方案:
备锅二口,注入卤水,烧至沸热,待盐锅中氯化钠饱和析出,捞出放入温锅中再洗,捞出沥干;随时用温锅的卤水补充至盐锅,温锅中也随时补充新卤水,保持两锅卤水体积不变,如此循环操作。
(4)循环若干次后,盐锅卤水中的 $ BaCl_2 $ 达到饱和。依据图乙,经过
降温
(填“降温”或“蒸发”)结晶可得到较纯净的 $ BaCl_2 $ 晶体。(5)从能量的角度看,安装温锅的作用是
节约能源
。(6)盐锅中捞出的 $ NaCl $ 晶体放入温锅中洗涤,而不直接使用水洗涤,其目的是:
①减少 $ NaCl $ 溶解损失;②
防止BaCl₂结晶,造成NaCl不纯
。
答案:
10.
(1)增大
(2)BaCl₂ + Na₂CO₃=BaCO₃↓ +2NaCl
(3)碳酸钠和氯化钡反应生成的碳酸钡能和胃液中的盐酸反应生成氯化钡、水和二氧化碳
(4)降温
(5)节约能源
(6)防止BaCl₂结晶,造成NaCl不纯
(1)增大
(2)BaCl₂ + Na₂CO₃=BaCO₃↓ +2NaCl
(3)碳酸钠和氯化钡反应生成的碳酸钡能和胃液中的盐酸反应生成氯化钡、水和二氧化碳
(4)降温
(5)节约能源
(6)防止BaCl₂结晶,造成NaCl不纯
查看更多完整答案,请扫码查看


