2025年启东中学作业本九年级化学上册人教版安徽专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年启东中学作业本九年级化学上册人教版安徽专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第46页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
13. A (2025·淮安)NH₄Cl、NaCl、NaHCO₃的溶解度曲线如图所示。
(1)P点的意义是
(2)60℃时50g水中加入28g NH₄Cl固体,形成
(3)下列叙述正确的是
A. 用搅拌的方法能增大NaCl在水中的溶解度
B. 60℃时,饱和溶液中的溶质质量:NH₄Cl>NaCl>NaHCO₃
C. 恒温蒸发溶剂,可使接近饱和的NaCl溶液变成饱和溶液
D. 等质量的饱和溶液,从60℃降温至t℃,析出晶体质量:NH₄Cl>NaCl
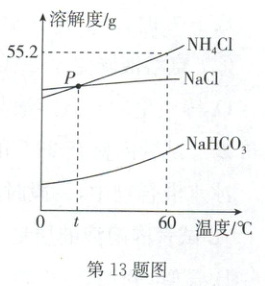
(1)P点的意义是
$t^{\circ}C$时,氯化钠与氯化铵的溶解度相等
。(2)60℃时50g水中加入28g NH₄Cl固体,形成
饱和
(填“饱和”或“不饱和”)溶液。(3)下列叙述正确的是
CD
(填字母)。A. 用搅拌的方法能增大NaCl在水中的溶解度
B. 60℃时,饱和溶液中的溶质质量:NH₄Cl>NaCl>NaHCO₃
C. 恒温蒸发溶剂,可使接近饱和的NaCl溶液变成饱和溶液
D. 等质量的饱和溶液,从60℃降温至t℃,析出晶体质量:NH₄Cl>NaCl

答案:
13.
(1)$t^{\circ}C$时,氯化钠与氯化铵的溶解度相等
(2)饱和
(3)CD
(1)$t^{\circ}C$时,氯化钠与氯化铵的溶解度相等
(2)饱和
(3)CD
14. A (2025·黑龙江)海洋蕴藏着丰富的资源,人类应合理开发和应用。海水中含有KCl和MgSO₄等物质,其在不同温度时的溶解度如下表所示,下图是对应的溶解度曲线。
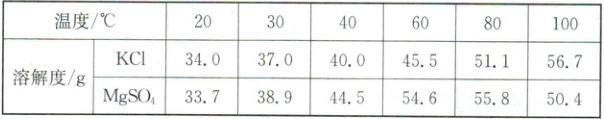
(1)代表KCl溶解度曲线的是
(2)40℃时,将30g KCl固体加入50g水中,充分溶解后,所得溶液的质量为
(3)t₂℃时,将等质量的甲、乙两物质的饱和溶液降温到t₁℃时,析出晶体的质量甲
(4)t₃℃时,将100g MgSO₄饱和溶液逐渐降温经t₂℃直至t₁℃,其溶质质量分数的变化趋势是

(1)代表KCl溶解度曲线的是
甲
(填“甲”或“乙”)。(2)40℃时,将30g KCl固体加入50g水中,充分溶解后,所得溶液的质量为
70
g。(3)t₂℃时,将等质量的甲、乙两物质的饱和溶液降温到t₁℃时,析出晶体的质量甲
=
(填“>”“<”或“=”)乙。(4)t₃℃时,将100g MgSO₄饱和溶液逐渐降温经t₂℃直至t₁℃,其溶质质量分数的变化趋势是
先不变后变小
。
答案:
14.
(1)甲
(2)70
(3)=
(4)先不变后变小
(1)甲
(2)70
(3)=
(4)先不变后变小
15. B NaCl在自然界分布很广,海水、盐湖、盐井和盐矿都是NaCl的来源。在地下千米左右的某盐矿储量巨大,85%是NaCl,还含有少量Na₂SO₄等。结合物质的溶解性及NaCl和Na₂SO₄的溶解度曲线,回答下列问题。

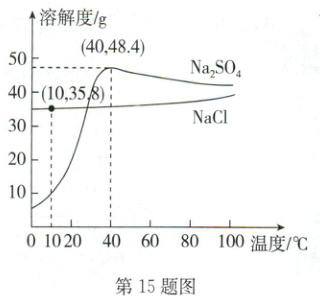
(1)NaCl属于
(2)10℃时,NaCl饱和溶液的溶质质量分数为
(3)生产时,向盐矿中注水制成溶液,再通过管道输回地面。冬天地面温度低于地下温度,需要输回的溶液中NaCl的质量分数略低于地面其饱和溶液的溶质质量分数,否则易结晶导致管道堵塞(忽略管道中水分的损失),原因是
(4)Na₂SO₄又称无水芒硝,是重要的化工原料。40℃时,输回地面的溶液分离出NaCl后,剩余溶液适宜采用


(1)NaCl属于
易溶
(填“易溶”或“可溶”)物质。(2)10℃时,NaCl饱和溶液的溶质质量分数为
$\frac{35.8g}{35.8g + 100g} × 100\%$
(列出计算式即可)。(3)生产时,向盐矿中注水制成溶液,再通过管道输回地面。冬天地面温度低于地下温度,需要输回的溶液中NaCl的质量分数略低于地面其饱和溶液的溶质质量分数,否则易结晶导致管道堵塞(忽略管道中水分的损失),原因是
氯化钠的溶解度随温度的降低而减小,降温后会从饱和溶液中析出
。(4)Na₂SO₄又称无水芒硝,是重要的化工原料。40℃时,输回地面的溶液分离出NaCl后,剩余溶液适宜采用
降温结晶
的方法获得硫酸钠晶体,实现“盐硝联产”,增效环保。
答案:
15.
(1)易溶
(2)$\frac{35.8g}{35.8g + 100g} × 100\%$
(3)氯化钠的溶解度随温度的降低而减小,降温后会从饱和溶液中析出
(4)降温结晶
(1)易溶
(2)$\frac{35.8g}{35.8g + 100g} × 100\%$
(3)氯化钠的溶解度随温度的降低而减小,降温后会从饱和溶液中析出
(4)降温结晶
查看更多完整答案,请扫码查看


