第45页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
7. 某校化学小组在利用稀硫酸和氢氧化钠溶液探究酸碱中和反应时,测得烧杯中溶液 pH 的变化如图 1 所示,两者反应的微观示意图如图 2 所示。
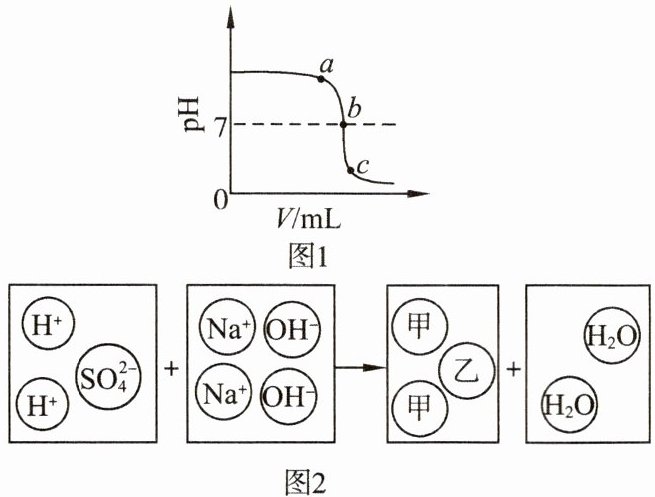
(1) 由图 1 可知,该实验是将
(2) 图 2 是两者恰好反应的微观示意图,甲、乙粒子的符号为

(1) 由图 1 可知,该实验是将
稀硫酸
逐滴滴入氢氧化钠溶液
中;a 点所示溶液呈碱
性;向 b 点所示溶液中滴加石蕊试液,溶液呈紫
色;c 点所示溶液中,含有的溶质是Na₂SO₄和H₂SO₄
。(2) 图 2 是两者恰好反应的微观示意图,甲、乙粒子的符号为
Na⁺、SO₄²⁻
,从微观角度分析,该反应的实质是H⁺和OH⁻结合生成H₂O
。
答案:
(1)稀硫酸 氢氧化钠溶液 碱 紫 Na₂SO₄和H₂SO₄
(2)Na⁺、SO₄²⁻ H⁺和OH⁻结合生成H₂O
(1)稀硫酸 氢氧化钠溶液 碱 紫 Na₂SO₄和H₂SO₄
(2)Na⁺、SO₄²⁻ H⁺和OH⁻结合生成H₂O
8. 用熟石灰中和一定量的盐酸时,溶液的 pH 与加入熟石灰质量的关系如图所示。熟石灰与盐酸反应的化学方程式为
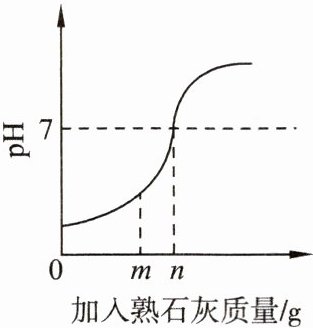
Ca(OH)₂+2HCl=CaCl₂+2H₂O
。当加入熟石灰 m g 时,溶液中的溶质为CaCl₂和HCl
。当两者恰好反应时,所用熟石灰的质量为n
g。若改用 n g 氢氧化钠与相同质量的盐酸反应,所得溶液的 pH<
7(填“>”“<”或“=”)。
答案:
Ca(OH)₂+2HCl=CaCl₂+2H₂O CaCl₂和HCl n <
9. 学习了酸和碱的化学性质后,同学们围绕“酸和碱的中和反应”开展了探究活动。请你参与学习并填写空格(已知:$Na_2SO_4+BaCl_2= 2NaCl+BaSO_4↓)。$
小军同学将一定量的稀硫酸加入盛有 NaOH 溶液的小烧杯中,一会儿后,发现忘记了滴加指示剂。于是他从烧杯中取出少量反应后的溶液于试管中,滴入几滴酚酞试液,振荡,观察到无明显现象。写出反应的化学方程式:
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中的溶质组成是什么?
【假设猜想】针对疑问,大家纷纷提出猜想。
猜想一:只有
猜想二:有$ Na_2SO_4 $和 NaOH;
猜想三:有$ Na_2SO_4 $和$ H_2SO_4。$
有同学对以上猜想提出质疑,认为有一种猜想是不合理的,不合理的是猜想
【实验探究】为了验证其余猜想,同学们利用烧杯中的溶液进行如下方案的探究。


【评价反思】
(1) 老师对同学们能用多种方法进行探究给予了肯定,同时指出实验方案中有一个是错误的,错误的原因是
(2) 除以上方案外,下列物质单独使用,也能证明猜想三正确的是
① 铁片 ② pH 试纸 ③ 氧化铁 ④ 紫色石蕊试液
小军同学将一定量的稀硫酸加入盛有 NaOH 溶液的小烧杯中,一会儿后,发现忘记了滴加指示剂。于是他从烧杯中取出少量反应后的溶液于试管中,滴入几滴酚酞试液,振荡,观察到无明显现象。写出反应的化学方程式:
H₂SO₄+2NaOH=Na₂SO₄+2H₂O
。【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中的溶质组成是什么?
【假设猜想】针对疑问,大家纷纷提出猜想。
猜想一:只有
Na₂SO₄
;猜想二:有$ Na_2SO_4 $和 NaOH;
猜想三:有$ Na_2SO_4 $和$ H_2SO_4。$
有同学对以上猜想提出质疑,认为有一种猜想是不合理的,不合理的是猜想
二
,理由为反应后的溶液中滴入酚酞试液无明显现象,说明一定不含NaOH
。【实验探究】为了验证其余猜想,同学们利用烧杯中的溶液进行如下方案的探究。


【评价反思】
(1) 老师对同学们能用多种方法进行探究给予了肯定,同时指出实验方案中有一个是错误的,错误的原因是
方案二只能证明溶液中含有SO₄²⁻,不能证明含有H₂SO₄(合理即可)
。(2) 除以上方案外,下列物质单独使用,也能证明猜想三正确的是
①②③④
(填序号)。① 铁片 ② pH 试纸 ③ 氧化铁 ④ 紫色石蕊试液
答案:
H₂SO₄+2NaOH=Na₂SO₄+2H₂O
【假设猜想】Na₂SO₄ 二 反应后的溶液中滴入酚酞试液无明显现象,说明一定不含NaOH
【实验探究】产生大量气泡 产生白色沉淀
【评价反思】
(1)方案二只能证明溶液中含有SO₄²⁻,不能证明含有H₂SO₄(合理即可)
(2)①②③④
【假设猜想】Na₂SO₄ 二 反应后的溶液中滴入酚酞试液无明显现象,说明一定不含NaOH
【实验探究】产生大量气泡 产生白色沉淀
【评价反思】
(1)方案二只能证明溶液中含有SO₄²⁻,不能证明含有H₂SO₄(合理即可)
(2)①②③④
查看更多完整答案,请扫码查看


