第91页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
6. 用如图所示装置(夹持装置已略去)和试剂进行模拟炼铁实验,测得甲中硬质玻璃管(含试剂)在反应前和完全反应后的质量分别为m₁和m₂。下列有关分析错误的是(
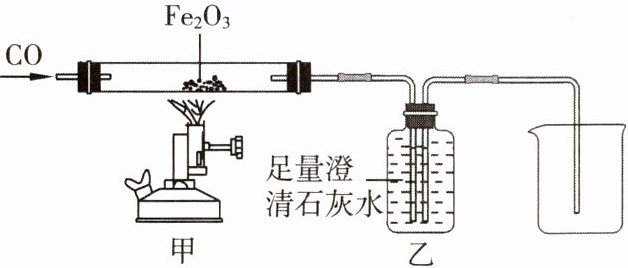
A.装置乙中澄清石灰水会变浑浊
B.停止加热后需要继续通CO直至冷却
C.该套装置的缺陷是没有用燃着的酒精灯处理尾气
D.氧化铁中氧元素的质量为(m₁−m₂)
C
)
A.装置乙中澄清石灰水会变浑浊
B.停止加热后需要继续通CO直至冷却
C.该套装置的缺陷是没有用燃着的酒精灯处理尾气
D.氧化铁中氧元素的质量为(m₁−m₂)
答案:
C
7. 生铁用途十分广泛。工业上利用赤铁矿(主要成分是Fe₂O₃,还含少量SiO₂等杂质)冶炼生铁的过程如下:
赤铁矿、焦炭、石灰石(主要成分CaCO₃)

回答下列问题:
(1) 生铁属于
(2) “煅烧”时:
① 生成CO的反应之一为$C+CO₂{\\overset{高温}{=}}2CO,$该反应属于
② 用化学方程式表示利用CO炼铁的原理:
③ CaCO₃和SiO₂固体在高温条件下发生反应,生成CO₂气体和CaSiO₃,该反应的化学方程式为
赤铁矿、焦炭、石灰石(主要成分CaCO₃)

回答下列问题:
(1) 生铁属于
金属
(填“合成”或“金属”)材料。“高炉气体”中的SO₂
(填化学式)会导致酸雨。(2) “煅烧”时:
① 生成CO的反应之一为$C+CO₂{\\overset{高温}{=}}2CO,$该反应属于
化合反应
(填基本反应类型)。② 用化学方程式表示利用CO炼铁的原理:
3CO+Fe₂O₃$\xlongequal{高温}$2Fe+3CO₂
。③ CaCO₃和SiO₂固体在高温条件下发生反应,生成CO₂气体和CaSiO₃,该反应的化学方程式为
CaCO₃+SiO₂$\xlongequal{高温}$CaSiO₃+CO₂↑
。
答案:
(1)金属 SO₂
(2)①化合反应 ②3CO+Fe₂O₃$\xlongequal{高温}$2Fe+3CO₂ ③CaCO₃+SiO₂$\xlongequal{高温}$CaSiO₃+CO₂↑
(1)金属 SO₂
(2)①化合反应 ②3CO+Fe₂O₃$\xlongequal{高温}$2Fe+3CO₂ ③CaCO₃+SiO₂$\xlongequal{高温}$CaSiO₃+CO₂↑
8. A~G是初中化学中常见的物质,其相互反应及转化关系如图所示,部分反应条件省略。已知A是易与人体血红蛋白结合的有毒气体,B是赤铁矿的主要成分,C是相对分子质量最小的氧化物,F是最轻的气体。
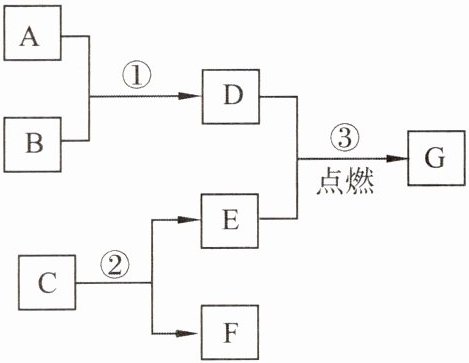
(1) G的化学式为
(2) 写出相应反应的化学方程式:①
(3) 反应③的实验现象是

(1) G的化学式为
Fe₃O₄
。(2) 写出相应反应的化学方程式:①
3CO+Fe₂O₃$\xlongequal{高温}$2Fe+3CO₂
,② 2H₂O$\xlongequal{通电}$2H₂↑+O₂↑
。(3) 反应③的实验现象是
剧烈燃烧,火星四射,放热,生成黑色固体
,反应的化学方程式为3Fe+2O₂$\xlongequal{点燃}$Fe₃O₄
。
答案:
(1)Fe₃O₄
(2)3CO+Fe₂O₃$\xlongequal{高温}$2Fe+3CO₂ 2H₂O$\xlongequal{通电}$2H₂↑+O₂↑
(3)剧烈燃烧,火星四射,放热,生成黑色固体 3Fe+2O₂$\xlongequal{点燃}$Fe₃O₄
(1)Fe₃O₄
(2)3CO+Fe₂O₃$\xlongequal{高温}$2Fe+3CO₂ 2H₂O$\xlongequal{通电}$2H₂↑+O₂↑
(3)剧烈燃烧,火星四射,放热,生成黑色固体 3Fe+2O₂$\xlongequal{点燃}$Fe₃O₄
9. 某化学实验小组利用以下装置测定某赤铁矿中氧化铁的纯度,向赤铁矿中通入纯净的一氧化碳气体,假设赤铁矿中杂质不参与反应,请回答下列问题:
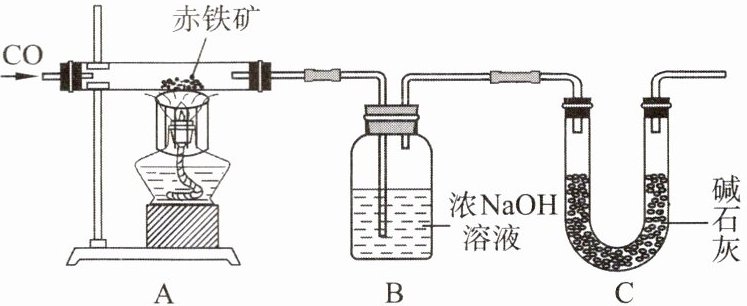
(1) 实验开始时,先进行的操作是
① 通入一氧化碳 ② 加热
(2) 实验过程中观察到装置A中玻璃管内发生的现象是
(3) 写出装置B中发生反应的化学方程式:
(4) 从环境保护的角度看,该实验存在的缺陷是
(5) 实验前称量赤铁矿的质量为20g,通入足量的一氧化碳完全反应后,装置B总质量增加了13.2g,则赤铁矿中氧化铁的纯度为

(1) 实验开始时,先进行的操作是
①
(填序号)。① 通入一氧化碳 ② 加热
(2) 实验过程中观察到装置A中玻璃管内发生的现象是
红色物质变黑
。(3) 写出装置B中发生反应的化学方程式:
CO₂+2NaOH=Na₂CO₃+H₂O
;装置C的作用是防止空气中的二氧化碳进入装置B中影响赤铁矿中氧化铁纯度的测定
。(4) 从环境保护的角度看,该实验存在的缺陷是
没有尾气处理(或应有尾气处理装置)
。(5) 实验前称量赤铁矿的质量为20g,通入足量的一氧化碳完全反应后,装置B总质量增加了13.2g,则赤铁矿中氧化铁的纯度为
80%
。
答案:
(1)①
(2)红色物质变黑
(3)CO₂+2NaOH$\xlongequal{}$Na₂CO₃+H₂O 防止空气中的二氧化碳进入装置B中影响赤铁矿中氧化铁纯度的测定
(4)没有尾气处理(或应有尾气处理装置)
(5)80%
(1)①
(2)红色物质变黑
(3)CO₂+2NaOH$\xlongequal{}$Na₂CO₃+H₂O 防止空气中的二氧化碳进入装置B中影响赤铁矿中氧化铁纯度的测定
(4)没有尾气处理(或应有尾气处理装置)
(5)80%
查看更多完整答案,请扫码查看


