第28页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
3. 不同酸溶液具有相似的化学性质,是因为都解离出相同的
(1)能使紫色石蕊试液
(2)酸 + 活泼金属→
(3)酸 + 某些金属氧化物→
(4)酸 + 某些盐→
氢离子(或H⁺)
。酸有以下相似化学性质(即酸的通性):(1)能使紫色石蕊试液
变红
;(2)酸 + 活泼金属→
盐
+ 氢气
;(3)酸 + 某些金属氧化物→
盐
+ 水
;(4)酸 + 某些盐→
新盐
+ 新酸
。
答案:
氢离子(或H⁺);变红;盐;氢气;盐;水;新盐;新酸
4. 不同酸溶液的化学性质也存在差异,是因为解离出不同的
阴离子(或酸根离子)
。例如:硫酸能与氯化钡溶液反应,反应现象为产生白色沉淀
,反应的化学方程式为H₂SO₄ + BaCl₂ = BaSO₄↓ + 2HCl
;而盐酸不与氯化钡溶液反应。
答案:
阴离子(或酸根离子);产生白色沉淀;H₂SO₄ + BaCl₂ = BaSO₄↓ + 2HCl
5. 常见酸的主要用途:70%以上硫酸用于生产
化肥
,其余主要用于生产农药
、炸药、染料及冶炼金属、精炼石油和金属除锈
等;盐酸用于制药、作除锈剂
。
答案:
化肥;农药;金属除锈;除锈剂
》例题 对比学习有利于发现事物的共性与个性。为探究酸的性质,同学们进行了如下实验。
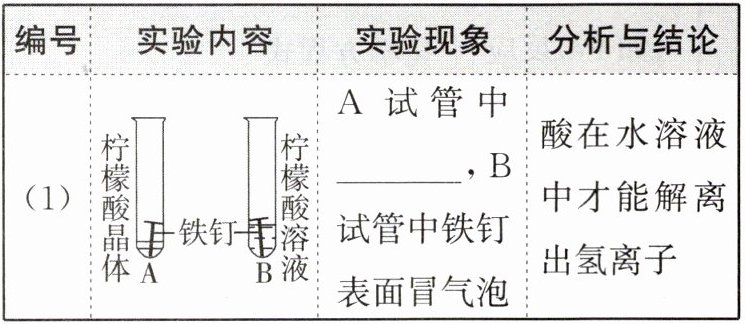

(1)
(2)
(3)
(4)


(1)
无明显现象
(2)
浓
;溶质质量分数
(3)
红色固体溶解,溶液由无色变为黄色
;H⁺
(4)
白色沉淀
;酸根离子
答案:
(1)无明显现象
(2)浓;溶质质量分数
(3)红色固体溶解,溶液由无色变为黄色;H⁺
(4)白色沉淀;酸根离子
(1)无明显现象
(2)浓;溶质质量分数
(3)红色固体溶解,溶液由无色变为黄色;H⁺
(4)白色沉淀;酸根离子
查看更多完整答案,请扫码查看


