第77页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
跨学科实践活动 2 制备五水硫酸铜晶体
【核心知识】
1. 溶解度与结晶方法
(1) 溶解度随温度变化的规律:硫酸铜的溶解度随温度升高显著增大。
(2) 结晶方法选择:若溶解度随温度变化大(如硫酸铜),应选择_______结晶法;若溶解度受温度影响小,则选择_______结晶法。
(3) 五水硫酸铜$(CuSO_4 \cdot 5H_2O)$的晶体结构特点:蓝色透明晶体,含结晶水,受热易失去结晶水变为白色粉末。
2. 实验操作要点
(1) 配制饱和溶液时需控制温度与溶剂量,避免_______混入。
(2) 降温速度影响晶体质量:降温过快会导致晶体_______,需通过水浴或自然冷却实现缓慢降温。
【设计先行】
任务:设计五水硫酸铜晶体制备方案
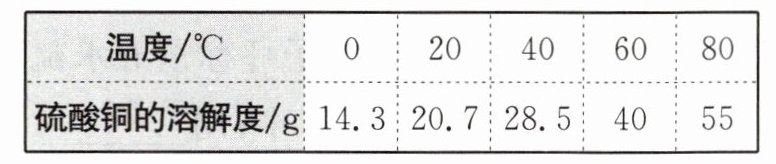
根据表中数据,回答以下问题:

1. 计算:若在$60℃$时量取$200mL$水加入_______g 硫酸铜晶体能配成饱和溶液。
2. 称量:用托盘天平或电子秤称量五水硫酸铜,放入干燥的_______中;用_______量取$200mL$水倒入烧杯中。
3. 加热溶解:用酒精灯加热至$60℃$左右,并用_______持续搅拌至完全溶解。
4. 降温结晶:把上述溶液静置并冷却到室温(可水浴冷却)。
5. 制备硫酸铜晶体:过滤硫酸铜溶液,选取规则的小晶体作为晶种,用尼龙线或棉线悬挂于滤液中静置几天,直到晶体体积明显变大。
6. 干燥:用滤纸吸干晶体表面水分,置于阴凉处风干。
【深化思考】
1. 若实验中未得到完整晶体,可能的原因有哪些?请指出两条并说明改进方法。
2. 为什么降温结晶法更适用于制备五水硫酸铜晶体?结合溶解度曲线解释。
3. 如何利用温度计和水浴装置精确控制降温速度?
4. 尝试设计一种晶体生长模具,使晶体形成特定形状(如星形),简述设计思路。
【核心知识】
1. 溶解度与结晶方法
(1) 溶解度随温度变化的规律:硫酸铜的溶解度随温度升高显著增大。
(2) 结晶方法选择:若溶解度随温度变化大(如硫酸铜),应选择_______结晶法;若溶解度受温度影响小,则选择_______结晶法。
(3) 五水硫酸铜$(CuSO_4 \cdot 5H_2O)$的晶体结构特点:蓝色透明晶体,含结晶水,受热易失去结晶水变为白色粉末。
2. 实验操作要点
(1) 配制饱和溶液时需控制温度与溶剂量,避免_______混入。
(2) 降温速度影响晶体质量:降温过快会导致晶体_______,需通过水浴或自然冷却实现缓慢降温。
【设计先行】
任务:设计五水硫酸铜晶体制备方案
根据表中数据,回答以下问题:

1. 计算:若在$60℃$时量取$200mL$水加入_______g 硫酸铜晶体能配成饱和溶液。
2. 称量:用托盘天平或电子秤称量五水硫酸铜,放入干燥的_______中;用_______量取$200mL$水倒入烧杯中。
3. 加热溶解:用酒精灯加热至$60℃$左右,并用_______持续搅拌至完全溶解。
4. 降温结晶:把上述溶液静置并冷却到室温(可水浴冷却)。
5. 制备硫酸铜晶体:过滤硫酸铜溶液,选取规则的小晶体作为晶种,用尼龙线或棉线悬挂于滤液中静置几天,直到晶体体积明显变大。
6. 干燥:用滤纸吸干晶体表面水分,置于阴凉处风干。
【深化思考】
1. 若实验中未得到完整晶体,可能的原因有哪些?请指出两条并说明改进方法。
2. 为什么降温结晶法更适用于制备五水硫酸铜晶体?结合溶解度曲线解释。
3. 如何利用温度计和水浴装置精确控制降温速度?
4. 尝试设计一种晶体生长模具,使晶体形成特定形状(如星形),简述设计思路。
答案:
(2)降温 蒸发
@@
(1)灰尘和杂质
(2)结晶不均匀不规则
@@1. 261.875 2. 烧杯;量筒 3. 玻璃棒 深化思考 1. 原因1:降温速度过快;改进:缓慢降温(如自然冷却或水浴控温缓慢降温)。 原因2:溶液未达饱和;改进:确保60℃时溶质完全溶解且达到饱和状态。 2. 五水硫酸铜溶解度随温度升高显著增大(如60℃溶解度83.8g,0℃23.1g),降温时溶解度急剧减小,易析出大量晶体,故适合降温结晶。 3. 用温度计监测水浴温度,通过向水浴中缓慢加入冷水或调节水浴散热速率,使温度计示数缓慢降低,控制溶液降温速度。 4. 制作星形透明模具(如塑料/玻璃),将晶种固定于模具中心,模具内壁设星形凹槽,引导晶体沿凹槽方向生长形成星形。
(2)降温 蒸发
@@
(1)灰尘和杂质
(2)结晶不均匀不规则
@@1. 261.875 2. 烧杯;量筒 3. 玻璃棒 深化思考 1. 原因1:降温速度过快;改进:缓慢降温(如自然冷却或水浴控温缓慢降温)。 原因2:溶液未达饱和;改进:确保60℃时溶质完全溶解且达到饱和状态。 2. 五水硫酸铜溶解度随温度升高显著增大(如60℃溶解度83.8g,0℃23.1g),降温时溶解度急剧减小,易析出大量晶体,故适合降温结晶。 3. 用温度计监测水浴温度,通过向水浴中缓慢加入冷水或调节水浴散热速率,使温度计示数缓慢降低,控制溶液降温速度。 4. 制作星形透明模具(如塑料/玻璃),将晶种固定于模具中心,模具内壁设星形凹槽,引导晶体沿凹槽方向生长形成星形。
1. 课外活动小组的同学们完成了自制硫酸铜晶体的实验(不考虑水分蒸发)。通过观察、分析、推理判断,总结出的下列观点中不合理的是(
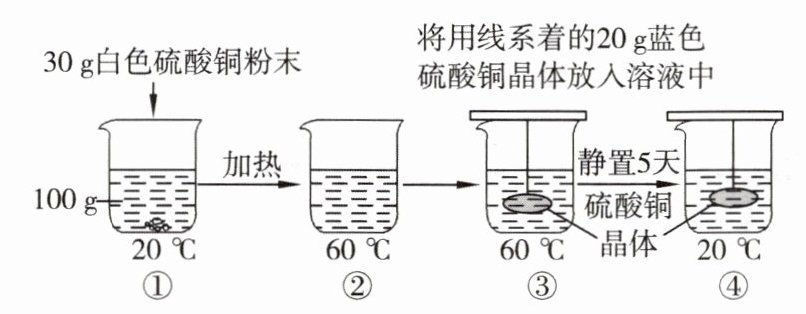
A.①中溶液为硫酸铜的饱和溶液
B.②→③过程中硫酸铜溶液的质量不变
C.①与④溶液的溶质质量分数相等
D.③→④过程中硫酸铜晶体逐渐变大
B
)

A.①中溶液为硫酸铜的饱和溶液
B.②→③过程中硫酸铜溶液的质量不变
C.①与④溶液的溶质质量分数相等
D.③→④过程中硫酸铜晶体逐渐变大
答案:
B
查看更多完整答案,请扫码查看


