第40页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
9. 为了比较活泼金属铝与相同 pH 的稀盐酸和稀硫酸反应的快慢,某化学兴趣小组做了如下探究实验。
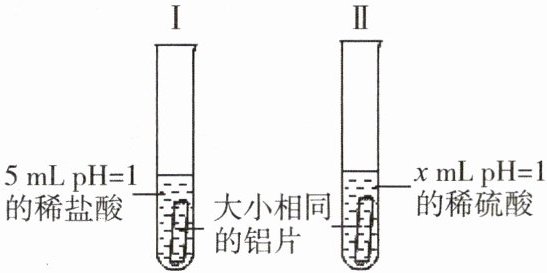
(1)根据酸的通性,尝试写出铝与稀硫酸反应的化学方程式:
(2)实验过程中,可以通过观察“产生气泡的快慢”来比较铝与稀盐酸和稀硫酸反应的剧烈程度,则 x=
(3)实验过程中,发现铝与稀盐酸反应更加剧烈。为进一步寻找原因,同学们提出了以下三种猜想并进行了实验:
【猜想】①试管Ⅰ中氯离子对反应起了促进作用;②试管Ⅱ中硫酸根离子对反应起了阻碍作用;③以上两种猜想同时成立。
【实验方案】向试管 I 中加入少量
A. 硫酸钠
B. 氯化钠
C. 浓盐酸
【结论】通过对比实验,观察到试管Ⅰ中反应快慢无明显变化,试管Ⅱ中反应明显加剧,则猜想①成立。

(1)根据酸的通性,尝试写出铝与稀硫酸反应的化学方程式:
2Al+3H₂SO₄=Al₂(SO₄)₃+3H₂↑
。(2)实验过程中,可以通过观察“产生气泡的快慢”来比较铝与稀盐酸和稀硫酸反应的剧烈程度,则 x=
5
。(3)实验过程中,发现铝与稀盐酸反应更加剧烈。为进一步寻找原因,同学们提出了以下三种猜想并进行了实验:
【猜想】①试管Ⅰ中氯离子对反应起了促进作用;②试管Ⅱ中硫酸根离子对反应起了阻碍作用;③以上两种猜想同时成立。
【实验方案】向试管 I 中加入少量
A
,向试管Ⅱ中加入少量B
,做对比实验。A. 硫酸钠
B. 氯化钠
C. 浓盐酸
【结论】通过对比实验,观察到试管Ⅰ中反应快慢无明显变化,试管Ⅱ中反应明显加剧,则猜想①成立。
答案:
(1)2Al+3H₂SO₄=Al₂(SO₄)₃+3H₂↑
(2)5
(3)A B
(1)2Al+3H₂SO₄=Al₂(SO₄)₃+3H₂↑
(2)5
(3)A B
10. 化学实验社团在老师的指导下开展了“模拟酸雨形成”的相关实验。
【联想与实验】模拟二氧化碳与水反应,进行如图 1 所示实验。
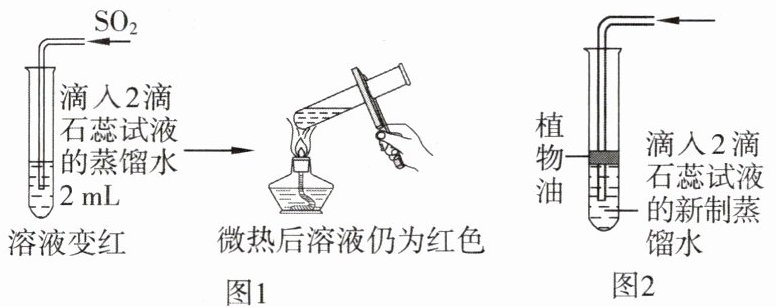
(1)二氧化硫与二氧化碳的化学性质相似,能与水反应生成亚硫酸$(H_2SO_3),$亚硫酸也不稳定。
(2)整个实验在通风橱中进行。
【问题与猜想】亚硫酸不稳定,为什么红色液体微热后不变为紫色?其原因可能为:猜想 1:加热不够充分;猜想 2:与空气中的氮气有关;猜想 3:与空气中的氧气有关。
【实验与验证】填写表格中的空格。
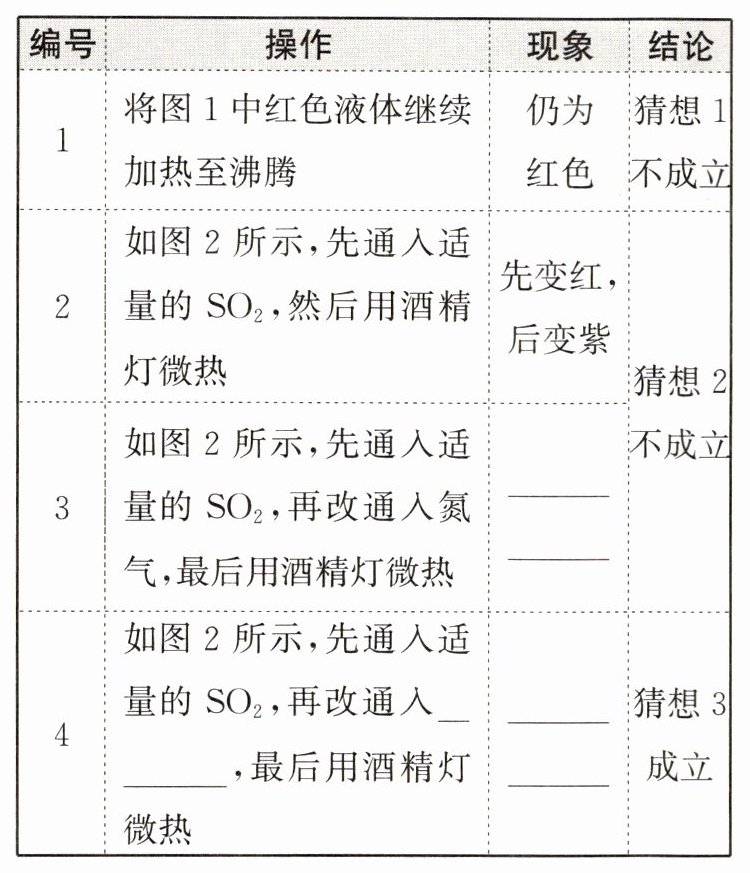
【分析与结论】红色液体微热后不变为紫色的原因是:$H_2SO_3 $在空气中会被氧气氧化成另一种酸,进一步实验证明是硫酸。
【实验与验证】
【联想与实验】模拟二氧化碳与水反应,进行如图 1 所示实验。

(1)二氧化硫与二氧化碳的化学性质相似,能与水反应生成亚硫酸$(H_2SO_3),$亚硫酸也不稳定。
(2)整个实验在通风橱中进行。
【问题与猜想】亚硫酸不稳定,为什么红色液体微热后不变为紫色?其原因可能为:猜想 1:加热不够充分;猜想 2:与空气中的氮气有关;猜想 3:与空气中的氧气有关。
【实验与验证】填写表格中的空格。

【分析与结论】红色液体微热后不变为紫色的原因是:$H_2SO_3 $在空气中会被氧气氧化成另一种酸,进一步实验证明是硫酸。
【实验与验证】
先变红,后变紫
O₂
先变红,加热后仍为红色
答案:
【实验与验证】先变红,后变紫 O₂ 先变红,加热后仍为红色
查看更多完整答案,请扫码查看


