第43页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
3. 在生活、生产和科研等方面,常利用中和反应原理来改变溶液的
(1) 医药卫生上:胃酸过多可服用碱性药物来中和过多盐酸,写出服用氢氧化铝治疗胃酸过多的化学方程式:
(2) 农业上:改良酸性土壤常用撒
(3) 工业上:当工厂排放的废水的含酸量超标,可以加入
(4) 科研上:在科学实验中,经常需要把溶液的 pH 控制在一定范围内,如果溶液的酸性太强,可以用适当的水或
酸碱性
,或降低环境中酸
或碱
的含量。(1) 医药卫生上:胃酸过多可服用碱性药物来中和过多盐酸,写出服用氢氧化铝治疗胃酸过多的化学方程式:
Al(OH)₃+3HCl=AlCl₃+3H₂O
。(2) 农业上:改良酸性土壤常用撒
熟石灰(或氢氧化钙)
的方法,写出改良含硫酸的土壤的化学方程式:Ca(OH)₂+H₂SO₄=CaSO₄+2H₂O
。(3) 工业上:当工厂排放的废水的含酸量超标,可以加入
氢氧化钙(或其他碱性物质)
进行中和处理,写出向含硝酸的废水中加氢氧化钙的反应化学方程式:Ca(OH)₂+2HNO₃=Ca(NO₃)₂+2H₂O
。(4) 科研上:在科学实验中,经常需要把溶液的 pH 控制在一定范围内,如果溶液的酸性太强,可以用适当的水或
碱性溶液
使溶液的 pH 增大;如果溶液的碱性太强,可以用适当的水或酸性溶液
使溶液的 pH 减小。
答案:
酸碱性;酸;碱
(1)Al(OH)₃+3HCl=AlCl₃+3H₂O
(2)熟石灰(或氢氧化钙);Ca(OH)₂+H₂SO₄=CaSO₄+2H₂O
(3)氢氧化钙(或其他碱性物质);Ca(OH)₂+2HNO₃=Ca(NO₃)₂+2H₂O
(4)碱性溶液;酸性溶液
(1)Al(OH)₃+3HCl=AlCl₃+3H₂O
(2)熟石灰(或氢氧化钙);Ca(OH)₂+H₂SO₄=CaSO₄+2H₂O
(3)氢氧化钙(或其他碱性物质);Ca(OH)₂+2HNO₃=Ca(NO₃)₂+2H₂O
(4)碱性溶液;酸性溶液
例题 中和反应在生产和生活中有广泛的应用。某同学利用图 1 装置研究稀盐酸与氢氧化钠溶液反应的过程,并用 pH 和温度传感器测量反应过程中相关物理量的变化情况,得到图 2 和图 3。
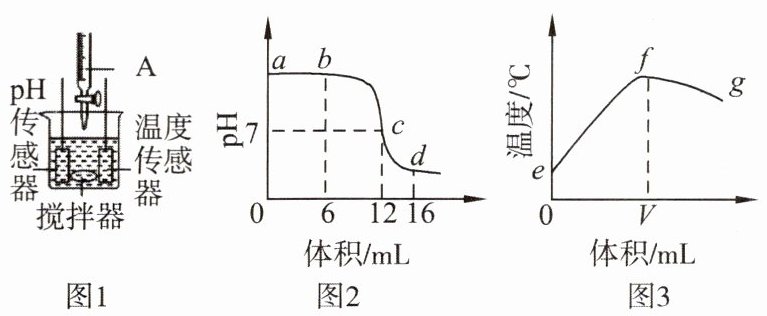
(1) 烧杯中发生反应的化学方程式为
(2) 根据图 2 中 pH 的变化,可推断出图 1 中仪器 A 中的溶液是
(3) 图 2 中 b 点所示溶液中的溶质是
(4) 图 3 中 e→f 变化趋势可说明该反应是

(1) 烧杯中发生反应的化学方程式为
NaOH+HCl= NaCl+H₂O
。(2) 根据图 2 中 pH 的变化,可推断出图 1 中仪器 A 中的溶液是
稀盐酸
。(3) 图 2 中 b 点所示溶液中的溶质是
NaCl、NaOH
(填化学式),若将 d 点所示溶液加热蒸干所得固体为纯净物
(填“纯净物”或“混合物”),c→d 所示溶液中 NaCl 的质量不变
(填“增加”“减小”或“不变”)。(4) 图 3 中 e→f 变化趋势可说明该反应是
放热
(填“放热”或“吸热”)反应,V 的数值最接近12
(填“6”“12”或“16”)。
答案:
解析:盐酸和氢氧化钠反应生成氯化钠和水。图 2 中由 pH>7 呈碱性至 pH= 7 呈中性,说明是向碱溶液中滴加酸溶液,故仪器 A 中溶液是稀盐酸。图 2 中 b 点所示溶液显碱性,稀盐酸和氢氧化钠反应生成氯化钠和水,故溶质是 NaCl 和 NaOH;d 点所示溶液显酸性,溶质是 NaCl 和 HCl,加热时 HCl 易挥发,蒸干所得固体为氯化钠,则为纯净物;c 点氢氧化钠和稀盐酸恰好完全反应,加入过量盐酸时不再生成氯化钠,则 c→d 所示溶液中 NaCl 的质量不变。由图 3 中 e→f 变化趋势是随着反应的进行,温度逐渐升高,则说明该反应是放热反应;最高点代表两者恰好完全反应,由于图 3 中 V 点位于最高温度的右侧,故 V 的数值最接近 12。
答案:$(1) NaOH+HCl= NaCl+H_2O$
(2) 稀盐酸
(3) NaCl、NaOH 纯净物 不变
(4) 放热 12
答案:$(1) NaOH+HCl= NaCl+H_2O$
(2) 稀盐酸
(3) NaCl、NaOH 纯净物 不变
(4) 放热 12
查看更多完整答案,请扫码查看


