第80页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
4. 氯化钠是生活必需品,也是重要的化工原料。粗盐中除了氯化钠外还含有少量的其他可溶性杂质和泥沙。为了除去粗盐中的泥沙并计算“精盐”的制得率,“启航”兴趣小组的同学设计了如图甲所示流程。
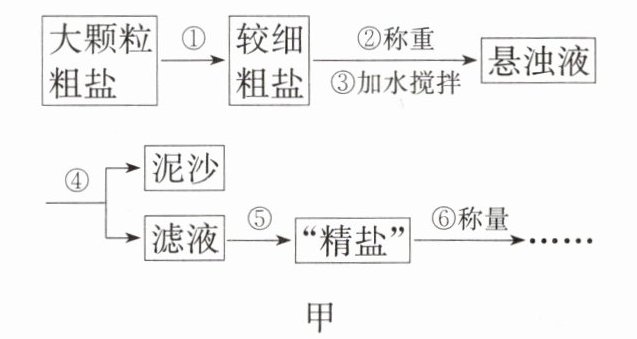
(1)操作①中必须用到的一种仪器是(
A. 研钵
B. 量筒
C. 烧杯
D. 试管
(2)操作④中需要将圆形滤纸折叠处理,下列图乙所示中不该出现的情形是(

(3)操作④经 2 次过滤后滤液仍然浑浊的原因是
(4)操作⑤的名称是

(1)操作①中必须用到的一种仪器是(
A
)(填序号)。A. 研钵
B. 量筒
C. 烧杯
D. 试管
(2)操作④中需要将圆形滤纸折叠处理,下列图乙所示中不该出现的情形是(
C
)(填序号)。
(3)操作④经 2 次过滤后滤液仍然浑浊的原因是
滤纸破损(合理即可)
(写一条即可)。(4)操作⑤的名称是
蒸发
,得到的“精盐”是否是纯净物?否
(填“是”或“否”),理由是精盐中还有可溶性杂质
。
答案:
(1)A
(2)C
(3)滤纸破损(合理即可)
(4)蒸发 否 精盐中还有可溶性杂质
(1)A
(2)C
(3)滤纸破损(合理即可)
(4)蒸发 否 精盐中还有可溶性杂质
5. 海水“晒盐”得到的粗盐,往往含有可溶性杂质和不溶性杂质,必须对其分离和提纯,才能用于工业生产和人们的日常生活。实验兴趣小组的同学们在实验室进行了一系列的探究活动,请你参与他们的活动。
探究一:粗盐中难溶性杂质的去除
(1)兴趣小组的同学进行粗盐提纯实验,实验过程如图所示。

① 蒸发时需要用到的下列仪器有______(填序号)。
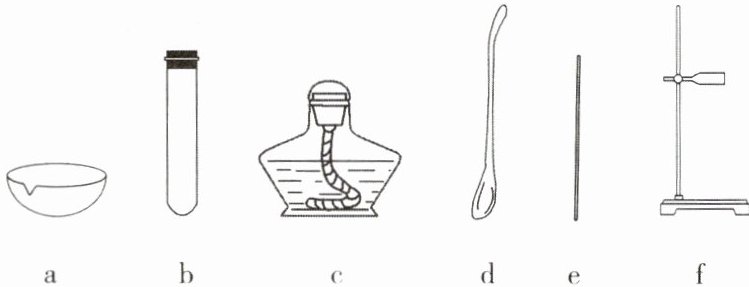
②下列关于该实验的分析正确的是______(填字母)。
A. 操作①利用了氯化钠易溶于水的性质
B. 操作③采用了蒸发溶剂的方法得到精盐
C. 若滤纸破损,精盐的产率偏高
D. 操作①和③中玻璃棒的作用相同
(2)探究二:除去粗盐中的可溶性杂质
除去难溶性杂质的粗盐样品中还含有少量的 $ CaCl_{2} $、$ MgCl_{2} $ 和 $ Na_{2}SO_{4} $。为了得到较纯净的食盐晶体,同学们设计如下实验方案。
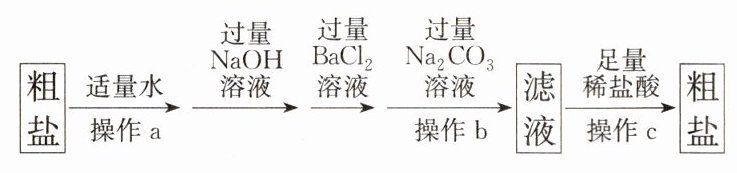
①实验中加入过量 $ Na_{2}CO_{3} $ 的目的是______,发生反应的化学方程式为______(写一个即可)。
②操作 b 所得滤渣的成分有______种(泥沙除外)。
③若实验过程中不考虑损耗,最终得到的 NaCl 固体的质量将大于固体混合物中 NaCl 的质量,整个过程中产生新的 NaCl 的反应共有______个。
④不能将过量的 NaOH 溶液换成 KOH 溶液,理由是______
______。
(1)①
(2)①
探究一:粗盐中难溶性杂质的去除
(1)兴趣小组的同学进行粗盐提纯实验,实验过程如图所示。

① 蒸发时需要用到的下列仪器有______(填序号)。

②下列关于该实验的分析正确的是______(填字母)。
A. 操作①利用了氯化钠易溶于水的性质
B. 操作③采用了蒸发溶剂的方法得到精盐
C. 若滤纸破损,精盐的产率偏高
D. 操作①和③中玻璃棒的作用相同
(2)探究二:除去粗盐中的可溶性杂质
除去难溶性杂质的粗盐样品中还含有少量的 $ CaCl_{2} $、$ MgCl_{2} $ 和 $ Na_{2}SO_{4} $。为了得到较纯净的食盐晶体,同学们设计如下实验方案。

①实验中加入过量 $ Na_{2}CO_{3} $ 的目的是______,发生反应的化学方程式为______(写一个即可)。
②操作 b 所得滤渣的成分有______种(泥沙除外)。
③若实验过程中不考虑损耗,最终得到的 NaCl 固体的质量将大于固体混合物中 NaCl 的质量,整个过程中产生新的 NaCl 的反应共有______个。
④不能将过量的 NaOH 溶液换成 KOH 溶液,理由是______
______。
(1)①
acef
②(ABC
)(2)①
除去氯化钙和过量的氯化钡
${CaCl_{2} +Na_{2}CO_{3}\xlongequal{}CaCO_{3}\downarrow +2NaCl}$或${BaCl_{2} +Na_{2}CO_{3}\xlongequal{}BaCO_{3}\downarrow +2NaCl}$
②4
③6
④会生成新的杂质氯化钾
答案:
(1)①acef ②ABC
(2)①除去氯化钙和过量的氯化钡 ${CaCl_{2} +Na_{2}CO_{3}\xlongequal{}CaCO_{3}\downarrow +2NaCl}$或${BaCl_{2} +Na_{2}CO_{3}\xlongequal{}BaCO_{3}\downarrow +2NaCl}$ ② 4 ③ 6 ④会生成新的杂质氯化钾
(1)①acef ②ABC
(2)①除去氯化钙和过量的氯化钡 ${CaCl_{2} +Na_{2}CO_{3}\xlongequal{}CaCO_{3}\downarrow +2NaCl}$或${BaCl_{2} +Na_{2}CO_{3}\xlongequal{}BaCO_{3}\downarrow +2NaCl}$ ② 4 ③ 6 ④会生成新的杂质氯化钾
查看更多完整答案,请扫码查看


