第88页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
- 第136页
- 第137页
- 第138页
- 第139页
- 第140页
- 第141页
- 第142页
- 第143页
- 第144页
- 第145页
- 第146页
- 第147页
- 第148页
- 第149页
- 第150页
- 第151页
- 第152页
- 第153页
- 第154页
- 第155页
- 第156页
- 第157页
- 第158页
- 第159页
- 第160页
- 第161页
- 第162页
- 第163页
- 第164页
- 第165页
- 第166页
- 第167页
- 第168页
- 第169页
- 第170页
- 第171页
- 第172页
- 第173页
- 第174页
- 第175页
- 第176页
- 第177页
- 第178页
- 第179页
- 第180页
- 第181页
- 第182页
- 第183页
1. (2024 秋·南宁月考)在“A + 3B = 2C + 2D”的反应中,已知 28 g 物质 A 完全反应生成 88 g 物质 C 和 36 g 物质 D,若 A 的相对分子质量为 28,则物质 B 的相对分子质量是(
A.96
B.48
C.32
D.16
C
)A.96
B.48
C.32
D.16
答案:
1.C
2. (2024·新疆中考)我国古代的“湿法炼铜”原理是 Fe + CuSO4 = FeSO4 + Cu。请根据化学方程式计算,用含 40 g 硫酸铜的溶液与足量的铁充分反应,理论上能得到铜的质量是多少?
答案:
2.【解析】根据参加反应的硫酸铜的质量,结合反应的化学方程式列式计算出理论上能得到铜的质量即可。
答案:解:设理论上能得到铜的质量为x。
Fe + CuSO₄ = FeSO₄ + Cu
160 64
40 g x
$\frac{160}{64}=\frac{40 g}{x} x = 16 g$
答:理论上能得到铜的质量为16 g。
答案:解:设理论上能得到铜的质量为x。
Fe + CuSO₄ = FeSO₄ + Cu
160 64
40 g x
$\frac{160}{64}=\frac{40 g}{x} x = 16 g$
答:理论上能得到铜的质量为16 g。
3. (2024·湖北中考)钛(Ti)和钛合金广泛用于火箭、导弹、航天飞机和通讯设备等。工业上生产钛的反应为 TiCl4 + 2Mg $\xlongequal{高温}$ 2MgCl2 + Ti。
(1)TiCl4 中钛、氯元素的质量比为
(2)若要生产 12 t 钛,至少需要镁的质量是多少?(写出计算过程)
(1)TiCl4 中钛、氯元素的质量比为
24∶71
。(2)若要生产 12 t 钛,至少需要镁的质量是多少?(写出计算过程)
答案:
3.
(1)24∶71
(2)解:设至少需要镁的质量为x,
$TiCl₄ + 2Mg \stackrel{高温}{=}2MgCl₂ + Ti$
48 48
x 12 t
$\frac{48}{48}=\frac{x}{12 t} x = 12 t$
答:至少需要镁的质量为12 t。
(1)24∶71
(2)解:设至少需要镁的质量为x,
$TiCl₄ + 2Mg \stackrel{高温}{=}2MgCl₂ + Ti$
48 48
x 12 t
$\frac{48}{48}=\frac{x}{12 t} x = 12 t$
答:至少需要镁的质量为12 t。
4. (2024 秋·南宁青秀区月考)实验室有不纯的高锰酸钾固体样品 40 g,将该高锰酸钾固体样品加热制取氧气(杂质不反应),充分反应后,固体混合物质量变化如下所示:
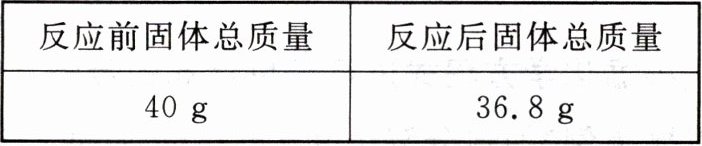
(1)反应中产生氧气的质量为
(2)求样品中高锰酸钾的质量。

(1)反应中产生氧气的质量为
3.2
g。(2)求样品中高锰酸钾的质量。
答案:
4.【解析】
(1)根据质量守恒定律可知,生成氧气的质量为40 g - 36.8 g = 3.2 g;
(2)根据生成氧气的质量,结合化学方程式,计算出参加反应的高锰酸钾的质量。
答案:
(1)3.2
(2)解:设样品中高锰酸钾的质量为x,
$2KMnO₄ \stackrel{△}{=}K₂MnO₄ + MnO₂ + O₂↑$
316 32
x 3.2 g
$\frac{316}{32}=\frac{x}{3.2 g} x = 31.6 g$
答:样品中高锰酸钾的质量为31.6 g。
(1)根据质量守恒定律可知,生成氧气的质量为40 g - 36.8 g = 3.2 g;
(2)根据生成氧气的质量,结合化学方程式,计算出参加反应的高锰酸钾的质量。
答案:
(1)3.2
(2)解:设样品中高锰酸钾的质量为x,
$2KMnO₄ \stackrel{△}{=}K₂MnO₄ + MnO₂ + O₂↑$
316 32
x 3.2 g
$\frac{316}{32}=\frac{x}{3.2 g} x = 31.6 g$
答:样品中高锰酸钾的质量为31.6 g。
(1)根据化学方程式计算的口诀:一解二设最后答,化学方程式不能差;准确找到质量比,纯量代入不掺假;所有单位须统一,列式计算解决它。
(2)如果题目未给出纯净物的质量,可通过反应前后的质量差来确定生成物中气体或沉淀的质量。
(2)如果题目未给出纯净物的质量,可通过反应前后的质量差来确定生成物中气体或沉淀的质量。
答案:
答案略
5. 在化学反应 A + 2B = C + 2D 中,已知 C 和 D 的相对分子质量之比是 22 : 9,当 6.4 g B 与足量 A 完全反应后,生成 3.6 g D。则在此反应中,B 和 C 的质量比是(
A.8 : 11
B.2 : 11
C.16 : 11
D.16 : 9
C
)A.8 : 11
B.2 : 11
C.16 : 11
D.16 : 9
答案:
5.C
6. (2024·宁夏中考)工业上用甲烷和二氧化碳在一定条件下反应生成氢气和一氧化碳,可以有效实现碳循环。
(1)请完成该化学方程式的配平:CH4 + CO2 $\xlongequal{一定条件}$ 2H2 +
(2)请计算每消耗 2.2 t 二氧化碳,可生成氢气的质量是多少?
(1)请完成该化学方程式的配平:CH4 + CO2 $\xlongequal{一定条件}$ 2H2 +
2
CO。(2)请计算每消耗 2.2 t 二氧化碳,可生成氢气的质量是多少?
答案:
6.
(1)2
(2)解:设生成氢气的质量为x,
$CH₄ + CO₂ \stackrel{一定条件}{=}2H₂ + 2CO$
44 4
2.2 t x
$\frac{44}{4}=\frac{2.2 t}{x} x = 0.2 t$
答:可生成氢气的质量是0.2 t。
(1)2
(2)解:设生成氢气的质量为x,
$CH₄ + CO₂ \stackrel{一定条件}{=}2H₂ + 2CO$
44 4
2.2 t x
$\frac{44}{4}=\frac{2.2 t}{x} x = 0.2 t$
答:可生成氢气的质量是0.2 t。
查看更多完整答案,请扫码查看


