第135页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
- 第136页
- 第137页
- 第138页
- 第139页
- 第140页
- 第141页
- 第142页
- 第143页
- 第144页
- 第145页
- 第146页
- 第147页
- 第148页
- 第149页
- 第150页
- 第151页
- 第152页
- 第153页
- 第154页
- 第155页
- 第156页
- 第157页
- 第158页
- 第159页
- 第160页
- 第161页
- 第162页
- 第163页
- 第164页
- 第165页
- 第166页
- 第167页
- 第168页
- 第169页
- 第170页
- 第171页
- 第172页
- 第173页
- 第174页
- 第175页
- 第176页
- 第177页
- 第178页
- 第179页
- 第180页
- 第181页
- 第182页
- 第183页
2. 为加深对燃烧条件的认识某同学设计了如图所示实验装置。(已知:白磷的着火点为$40^{\circ }C$,红磷的着火点为$260^{\circ }C$)
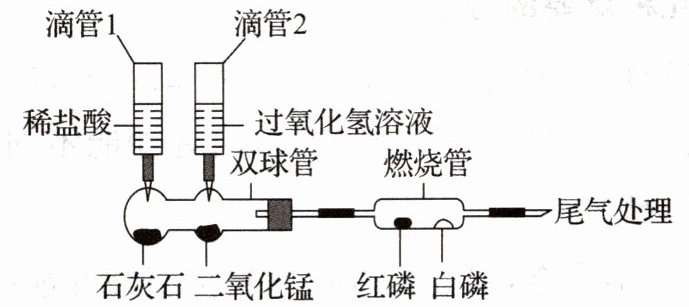
(1) 挤压滴管 1,一段时间后,加热燃烧管至$260^{\circ }C$以上,燃烧管中白磷和红磷均不燃烧,从燃烧条件的角度分析其原因是
(2) 挤压滴管 2,一段时间后;微热燃烧管至$80^{\circ }C$。观察到
(3) 挤压滴管 2 后,双球管中发生反应的化学方程式为
(4) 实验反思:使用该装置进行实验的优点是

(1) 挤压滴管 1,一段时间后,加热燃烧管至$260^{\circ }C$以上,燃烧管中白磷和红磷均不燃烧,从燃烧条件的角度分析其原因是
没有与氧气接触
。(2) 挤压滴管 2,一段时间后;微热燃烧管至$80^{\circ }C$。观察到
白磷燃烧,红磷不燃烧
(填实验现象),得出燃烧需要温度达到可燃物的着火点。(3) 挤压滴管 2 后,双球管中发生反应的化学方程式为
${2H2O2\xlongequal{MnO2}2H2O + O2\uparrow}$
。(4) 实验反思:使用该装置进行实验的优点是
节约试剂、减少污染
。
答案:
2.
(1)没有与氧气接触
(2)白磷燃烧,红磷不燃烧
(3)${2H2O2\xlongequal{MnO2}2H2O + O2\uparrow}$
(4)节约试剂、减少污染
(1)没有与氧气接触
(2)白磷燃烧,红磷不燃烧
(3)${2H2O2\xlongequal{MnO2}2H2O + O2\uparrow}$
(4)节约试剂、减少污染
3. 掌握燃烧的条件和灭火的原理,对于科学利用和控制燃烧反应非常重要。
普通电子打火机的构造如图

查阅资料:常温常压下,汽油的沸点范围是$30\sim 205^{\circ }C$,着火点约为$427^{\circ }C$。丁烷常温常压下是一种无色、易液化的气体,沸点为$-0.5^{\circ }C$,着火点约为$405^{\circ }C$。打火机的原理主要利用了压电效应,按下开关的瞬间,储气阀门开启,释放出气态丁烷,同时压电陶瓷产生电火花,温度可达$1000^{\circ }C$以上。
(1) 从燃烧条件分析,金属防风罩留有许多孔的原因是
(2) 阅读资料并结合燃烧的条件分析,打火机内的燃料通常选用丁烷而不选用汽油等液态燃料的原因:
(3) 如果使用或保存不当,打火机也容易发生爆炸,为防止打火机发生爆炸,保存打火机时我们应该注意的是
(4) 松开按下的打火机的开关,储气阀门关闭,火焰熄灭,利用的灭火原理是
普通电子打火机的构造如图

查阅资料:常温常压下,汽油的沸点范围是$30\sim 205^{\circ }C$,着火点约为$427^{\circ }C$。丁烷常温常压下是一种无色、易液化的气体,沸点为$-0.5^{\circ }C$,着火点约为$405^{\circ }C$。打火机的原理主要利用了压电效应,按下开关的瞬间,储气阀门开启,释放出气态丁烷,同时压电陶瓷产生电火花,温度可达$1000^{\circ }C$以上。
(1) 从燃烧条件分析,金属防风罩留有许多孔的原因是
使可燃物与氧气充分接触
。(2) 阅读资料并结合燃烧的条件分析,打火机内的燃料通常选用丁烷而不选用汽油等液态燃料的原因:
丁烷的沸点低,易气化
(写一条)。(3) 如果使用或保存不当,打火机也容易发生爆炸,为防止打火机发生爆炸,保存打火机时我们应该注意的是
远离火源
(写一条)。(4) 松开按下的打火机的开关,储气阀门关闭,火焰熄灭,利用的灭火原理是
隔离可燃物
。
答案:
3.【解析】
(1)燃烧需要可燃物与氧气充分接触,从燃烧条件分析,金属防风罩留有许多孔的原因是使可燃物与氧气充分接触。
(2)由查阅资料可知,打火机内的燃料通常选用丁烷而不选用汽油等液态燃料的原因有丁烷的沸点低,易气化,易被点燃;汽油的沸点范围是$30^{\circ}C$到$205^{\circ}C$,不易气化。
(3)为防止打火机发生爆炸,保存打火机时我们应该注意的是远离火源或高温环境,避免挤压或撞击。
(4)松开按下的打火机的开关,储气阀门关闭,火焰熄灭,利用的灭火原理是隔离可燃物。答案:
(1)使可燃物与氧气充分接触
(2)丁烷的沸点低,易气化(合理即可)
(3)远离火源(合理即可)
(4)隔离可燃物
(1)燃烧需要可燃物与氧气充分接触,从燃烧条件分析,金属防风罩留有许多孔的原因是使可燃物与氧气充分接触。
(2)由查阅资料可知,打火机内的燃料通常选用丁烷而不选用汽油等液态燃料的原因有丁烷的沸点低,易气化,易被点燃;汽油的沸点范围是$30^{\circ}C$到$205^{\circ}C$,不易气化。
(3)为防止打火机发生爆炸,保存打火机时我们应该注意的是远离火源或高温环境,避免挤压或撞击。
(4)松开按下的打火机的开关,储气阀门关闭,火焰熄灭,利用的灭火原理是隔离可燃物。答案:
(1)使可燃物与氧气充分接触
(2)丁烷的沸点低,易气化(合理即可)
(3)远离火源(合理即可)
(4)隔离可燃物
4. (2024 秋·河池期末)宏观、微观、符号相结合是化学独特的表示物质及其变化的方法。阅读下面材料回答问题。
甲醇制氢加氢一体站已投入使用,为解决目前氢能发展面临的运输、存储难题提供了新路径。中国是世界上最大的甲醇生产国,约占全球甲醇产能的 60%,甲醇来源丰富、成本低廉,常温常压下作为液体便于储存和运输。
(1) 用甲醇制取氢气的优点是
(2) 如图是氢原子的结构示意图,$n=$
(3) 如图是甲醇($CH_{3}OH$)和水蒸气重整制氢的微观反应示意图。

写出该反应的化学方程式
反应生成两种物质的质量比为
(4) 用氢气做燃料的优点是
甲醇制氢加氢一体站已投入使用,为解决目前氢能发展面临的运输、存储难题提供了新路径。中国是世界上最大的甲醇生产国,约占全球甲醇产能的 60%,甲醇来源丰富、成本低廉,常温常压下作为液体便于储存和运输。
(1) 用甲醇制取氢气的优点是
制氢原料来源丰富
(写一条)。(2) 如图是氢原子的结构示意图,$n=$
1
。(3) 如图是甲醇($CH_{3}OH$)和水蒸气重整制氢的微观反应示意图。

写出该反应的化学方程式
${CH3OH + H2O\xlongequal{催化剂}3H2 + CO2}$
;反应生成两种物质的质量比为
3:22
。(4) 用氢气做燃料的优点是
生成物是水,环保无污染
。
答案:
4.【解析】
(1)用甲醇制取氢气的优点:制氢原料来源丰富、成本低廉;
(2)在原子中,核电荷数=质子数=核外电子数,故$n = 1$;
(3)甲醇和水在催化剂的催化作用下生成氢气和二氧化碳,反应的化学方程式为${CH3OH + H2O\xlongequal{催化剂}3H2 + CO2}$;由反应的化学方程式可知,反应生成的氢气和二氧化碳的质量比为$(3×2):(12 + 16×2)=3:22$;
(4)用氢气做燃料的优点为生成物是水,环保无污染。答案:
(1)制氢原料来源丰富(或成本低廉)
(2)1
(3)${CH3OH + H2O\xlongequal{催化剂}3H2 + CO2}$ 3:22
(4)生成物是水,环保无污染
(1)用甲醇制取氢气的优点:制氢原料来源丰富、成本低廉;
(2)在原子中,核电荷数=质子数=核外电子数,故$n = 1$;
(3)甲醇和水在催化剂的催化作用下生成氢气和二氧化碳,反应的化学方程式为${CH3OH + H2O\xlongequal{催化剂}3H2 + CO2}$;由反应的化学方程式可知,反应生成的氢气和二氧化碳的质量比为$(3×2):(12 + 16×2)=3:22$;
(4)用氢气做燃料的优点为生成物是水,环保无污染。答案:
(1)制氢原料来源丰富(或成本低廉)
(2)1
(3)${CH3OH + H2O\xlongequal{催化剂}3H2 + CO2}$ 3:22
(4)生成物是水,环保无污染
查看更多完整答案,请扫码查看


