第157页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
- 第136页
- 第137页
- 第138页
- 第139页
- 第140页
- 第141页
- 第142页
- 第143页
- 第144页
- 第145页
- 第146页
- 第147页
- 第148页
- 第149页
- 第150页
- 第151页
- 第152页
- 第153页
- 第154页
- 第155页
- 第156页
- 第157页
- 第158页
- 第159页
- 第160页
- 第161页
- 第162页
- 第163页
- 第164页
- 第165页
- 第166页
- 第167页
- 第168页
- 第169页
- 第170页
- 第171页
- 第172页
- 第173页
- 第174页
- 第175页
- 第176页
- 第177页
- 第178页
- 第179页
- 第180页
- 第181页
- 第182页
- 第183页
1. 下列生活用品,利用金属导电性的是 (
A.铁锅
B.铜导线
C.铝箔包装纸
D.金饰品
B
)A.铁锅
B.铜导线
C.铝箔包装纸
D.金饰品
答案:
1.B
2. (2024·湖北中考)湖北省博物馆馆藏的越王勾践青铜剑,其主要成分为铜锡合金。下列有关铜锡合金说法正确的是 (
A.属于金属材料
B.熔点高于纯铜
C.硬度低于纯锡
D.铜、锡均能与稀硫酸反应
A
)A.属于金属材料
B.熔点高于纯铜
C.硬度低于纯锡
D.铜、锡均能与稀硫酸反应
答案:
2.A
3. 下列有关金属的实验,说法不正确的是(
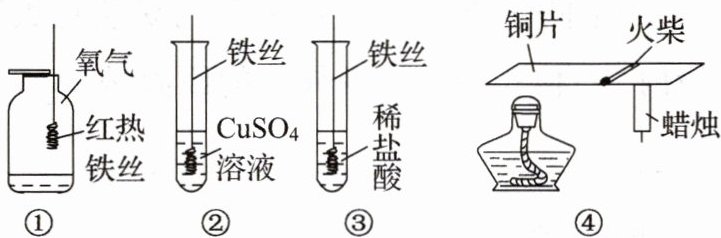
A.①中铁丝燃烧生成的黑色固体物质是氧化铁
B.实验②可以验证铁的金属活动性强于铜
C.③中有气泡产生
D.④能说明铜具有导热性
A
)
A.①中铁丝燃烧生成的黑色固体物质是氧化铁
B.实验②可以验证铁的金属活动性强于铜
C.③中有气泡产生
D.④能说明铜具有导热性
答案:
3.A
4. 根据反应:$ {Cu + Hg(NO_{3})_{2} \xlongequal{} Cu(NO_{3})_{2} + Hg} $,$ {Mn + CuSO_{4} \xlongequal{} MnSO_{4} + Cu} $判断金属活动性的顺序 (
A.$ {Cu > Mn > Hg} $
B.$ {Hg > Cu > Mn} $
C.$ {Mn > Hg > Cu} $
D.$ {Mn > Cu > Hg} $
D
)A.$ {Cu > Mn > Hg} $
B.$ {Hg > Cu > Mn} $
C.$ {Mn > Hg > Cu} $
D.$ {Mn > Cu > Hg} $
答案:
4.D
5. (2024·重庆中考B卷)锂(Li)离子电池应用广泛,有利于电动汽车的不断发展。
(1) Li
(2) 锂离子电池中含有铝箔,通常由铝锭打造而成,说明铝具有良好的
(3) 锂离子电池中还含有铜箔,为验证铝和铜的金属活动性顺序,设计了如下实验:
【方案一】将铝片和铜片相互刻画,金属片上出现痕迹者更活泼。
【方案二】将铝丝和铜丝表面打磨后,同时放入5mL相同的稀盐酸中,金属丝表面产生气泡者更活泼。
【方案三】将铝丝和铜丝表面打磨后,同时放入5mL相同的硝酸银溶液中,金属丝表面有银白色物质析出者更活泼。
以上方案中,你认为能达到实验目的的是
(1) Li
失去
(填“得到”或“失去”)电子变成$ {Li^{+}} $。(2) 锂离子电池中含有铝箔,通常由铝锭打造而成,说明铝具有良好的
延展
性。(3) 锂离子电池中还含有铜箔,为验证铝和铜的金属活动性顺序,设计了如下实验:
【方案一】将铝片和铜片相互刻画,金属片上出现痕迹者更活泼。
【方案二】将铝丝和铜丝表面打磨后,同时放入5mL相同的稀盐酸中,金属丝表面产生气泡者更活泼。
【方案三】将铝丝和铜丝表面打磨后,同时放入5mL相同的硝酸银溶液中,金属丝表面有银白色物质析出者更活泼。
以上方案中,你认为能达到实验目的的是
二
(填方案序号),该方案中发生反应的化学方程式为2
。Al+6HCl=2AlCl₃+3H₂↑
答案:
5.【解析】
(1)锂原子最外层电子数是1,在化学反应中容易失去电子变成带1个单位正电荷的锂离子;
(2)铝箔是由铝锭打造而成,说明铝具有良好的延展性;
(3)方案一:将铝片和铜片相互刻画,金属片上出现痕迹者,只能说明该金属硬度更小,不能判断铝和铜的金属活动性强弱,错误;方案二:将铝丝和铜丝表面打磨后,同时放入5mL相同的稀盐酸中,铝丝表面产生气泡,铜丝无现象,说明铝的金属活动性比氢强,铜的金属活动性比氢弱,即Al>H>Cu,铝和稀盐酸反应生成氯化铝和氢气,正确;方案三:将铝丝和铜丝表面打磨后,同时放入5mL相同的硝酸银溶液中,铝丝和铜丝表面都有银白色物质析出,说明铝和铜都比银活泼,而铝和铜的金属活动性无法判断,错误。
答案:
(1)失去
(2)延展
(3)二 2Al+6HCl=2AlCl₃+3H₂↑
(1)锂原子最外层电子数是1,在化学反应中容易失去电子变成带1个单位正电荷的锂离子;
(2)铝箔是由铝锭打造而成,说明铝具有良好的延展性;
(3)方案一:将铝片和铜片相互刻画,金属片上出现痕迹者,只能说明该金属硬度更小,不能判断铝和铜的金属活动性强弱,错误;方案二:将铝丝和铜丝表面打磨后,同时放入5mL相同的稀盐酸中,铝丝表面产生气泡,铜丝无现象,说明铝的金属活动性比氢强,铜的金属活动性比氢弱,即Al>H>Cu,铝和稀盐酸反应生成氯化铝和氢气,正确;方案三:将铝丝和铜丝表面打磨后,同时放入5mL相同的硝酸银溶液中,铝丝和铜丝表面都有银白色物质析出,说明铝和铜都比银活泼,而铝和铜的金属活动性无法判断,错误。
答案:
(1)失去
(2)延展
(3)二 2Al+6HCl=2AlCl₃+3H₂↑
6. 广西蕴藏丰富的铝、锰、锌、铁、铜、银等矿产资源。合理开采、充分利用这些矿产资源,可实现“富矿精开”。
(1) 铝具有很好的抗腐蚀性,因为铝在空气中能与氧气反应形成一层致密的氧化铝薄膜,反应的化学方程式为
(2) 分别在放有锰片、铜片的试管中加入稀硫酸,锰片表面有气泡产生,铜片表面无明显变化。由此可知金属活动性:锰
(3) 向$ {Cu(NO_{3})_{2}} $、$ {Al(NO_{3})_{3}} $和$ {AgNO_{3}} $的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤出的固体中滴加稀硫酸有气泡产生,则滤出的固体中一定有金属单质
(1) 铝具有很好的抗腐蚀性,因为铝在空气中能与氧气反应形成一层致密的氧化铝薄膜,反应的化学方程式为
4Al+3O₂=2Al₂O₃
。(2) 分别在放有锰片、铜片的试管中加入稀硫酸,锰片表面有气泡产生,铜片表面无明显变化。由此可知金属活动性:锰
强
(选填“强”或“弱”)于铜。(3) 向$ {Cu(NO_{3})_{2}} $、$ {Al(NO_{3})_{3}} $和$ {AgNO_{3}} $的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤出的固体中滴加稀硫酸有气泡产生,则滤出的固体中一定有金属单质
银、铜、铁
,滤液中含有的金属离子为Al³⁺、Fe²⁺
,有关化学反应的方程式为Fe+2AgNO₃=Fe(NO₃)₂+2Ag
(写出一个即可)。
答案:
6.
(1)4Al+3O₂=2Al₂O₃
(2)强
(3)银、铜、铁 Al³⁺、Fe²⁺ Fe+2AgNO₃=Fe(NO₃)₂+2Ag(或Fe+Cu(NO₃)₂=Fe(NO₃)₂+Cu)
(1)4Al+3O₂=2Al₂O₃
(2)强
(3)银、铜、铁 Al³⁺、Fe²⁺ Fe+2AgNO₃=Fe(NO₃)₂+2Ag(或Fe+Cu(NO₃)₂=Fe(NO₃)₂+Cu)
7. 为探究Al、Cu、Ag的活动性顺序,某兴趣小组做了如下实验:

(1) 实验前需要将金属丝打磨,目的是
(2) 甲实验中的现象为
(3) 通过甲、乙实验的探究,可得出三种金属的活动性由强到弱的顺序为
(4) 若采用丙实验方案也可得出相同结论,则溶液C为

(1) 实验前需要将金属丝打磨,目的是
除去金属表面的氧化物膜
。(2) 甲实验中的现象为
铜丝表面有银白色物质生成,且溶液由无色变为蓝色
;乙实验中发生反应的化学方程式为2Al+3CuSO₄=Al₂(SO₄)₃+3Cu
。(3) 通过甲、乙实验的探究,可得出三种金属的活动性由强到弱的顺序为
Al、Cu、Ag
。(4) 若采用丙实验方案也可得出相同结论,则溶液C为
CuSO₄溶液
。
答案:
7.【解析】
(1)由于常见的金属易与空气中氧气反应在其表面形成氧化物膜,实验前需要将金属丝打磨,目的是除去金属表面的氧化物膜。
(2)由于铜与硝酸银反应生成了银和硝酸铜,所以甲实验中的现象为铜丝表面有银白色物质生成,且溶液由无色变为蓝色;乙实验中铝与硫酸铜反应生成了硫酸铝和铜,发生反应的化学方程式为2Al+3CuSO₄=Al₂(SO₄)₃+3Cu。
(3)通过甲、乙实验的探究,由上述分析可得出三种金属的活动性由强到弱的顺序为Al、Cu、Ag。
(4)若采用丙实验方案也可得出相同结论,该实验利用的“两金夹一盐”的实验方法,由实验可知,溶液C为CuSO₄溶液等。
答案:
(1)除去金属表面的氧化物膜
(2)铜丝表面有银白色物质生成,且溶液由无色变为蓝色 2Al+3CuSO₄=Al₂(SO₄)₃+3Cu
(3)Al、Cu、Ag
(4)CuSO₄溶液(合理即可)
(1)由于常见的金属易与空气中氧气反应在其表面形成氧化物膜,实验前需要将金属丝打磨,目的是除去金属表面的氧化物膜。
(2)由于铜与硝酸银反应生成了银和硝酸铜,所以甲实验中的现象为铜丝表面有银白色物质生成,且溶液由无色变为蓝色;乙实验中铝与硫酸铜反应生成了硫酸铝和铜,发生反应的化学方程式为2Al+3CuSO₄=Al₂(SO₄)₃+3Cu。
(3)通过甲、乙实验的探究,由上述分析可得出三种金属的活动性由强到弱的顺序为Al、Cu、Ag。
(4)若采用丙实验方案也可得出相同结论,该实验利用的“两金夹一盐”的实验方法,由实验可知,溶液C为CuSO₄溶液等。
答案:
(1)除去金属表面的氧化物膜
(2)铜丝表面有银白色物质生成,且溶液由无色变为蓝色 2Al+3CuSO₄=Al₂(SO₄)₃+3Cu
(3)Al、Cu、Ag
(4)CuSO₄溶液(合理即可)
查看更多完整答案,请扫码查看


