2025年新坐标同步练习高中化学选择性必修第二册人教版青海专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年新坐标同步练习高中化学选择性必修第二册人教版青海专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第8页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
1.电子自旋与泡利原理
(1)自旋:电子自旋在空间有1
(2)泡利原理(也称泡利不相容原理):在一个原子轨道里,最多只能容纳3
(1)自旋:电子自旋在空间有1
顺时针
和2逆时针
两种取向,简称自旋相反,常用上下箭头(↑和↓)表示自旋相反的电子。(2)泡利原理(也称泡利不相容原理):在一个原子轨道里,最多只能容纳3
2
个电子,它们的自旋4相反
。
答案:
①顺时针;②逆时针;③2;④相反
2.电子排布的轨道表示式(电子排布图)
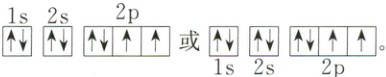
在轨道表示式中,用方框(也可用圆圈)表示原子轨道。例如,基态O原子的轨道表示式如下:
$1s$ $2s$ $2p$ $\uparrow\downarrow$ $\uparrow\downarrow$ $\uparrow\uparrow\uparrow或\uparrow\downarrow$ $\uparrow\downarrow$ $\uparrow\uparrow\uparrow$
(1)简并轨道:5
(2)电子对:在同一个原子轨道中,自旋方向6
(3)单电子:一个原子轨道中,若只有一个电子,则该电子称为单电子,用“↑”或“↓”表示,又称8
(4)自旋平行:箭头9
(5)氧原子中,有11
在轨道表示式中,用方框(也可用圆圈)表示原子轨道。例如,基态O原子的轨道表示式如下:
$1s$ $2s$ $2p$ $\uparrow\downarrow$ $\uparrow\downarrow$ $\uparrow\uparrow\uparrow或\uparrow\downarrow$ $\uparrow\downarrow$ $\uparrow\uparrow\uparrow$

(1)简并轨道:5
能量相同
的原子轨道。(2)电子对:在同一个原子轨道中,自旋方向6
相反
的一对电子,用“7$\uparrow\downarrow$
”表示。(3)单电子:一个原子轨道中,若只有一个电子,则该电子称为单电子,用“↑”或“↓”表示,又称8
未成对电子
。(4)自旋平行:箭头9
同向
的单电子。如基态O原子有102
个自旋平行的2p电子。(5)氧原子中,有11
3
个电子对,有122
个单电子,电子的运动状态有138
种,空间运动状态有145
种。
答案:
⑤能量相同;⑥相反;⑦$\uparrow\downarrow$;⑧未成对电子;⑨同向;⑩2;⑪3;⑫2;⑬8;⑭5
3.洪特规则
(1)含义:基态原子中,填入简并轨道的电子总是先15
(2)补充内容:在简并轨道上的电子排布处于全充满、半充满和全空状态时,具有较低的能量和较强的稳定性。
全充满:$p^{6}、d^{10}、f^{14}$
相对稳定的状态 半充满:$p^{3}、d^{5}、f^{7}$
全空:$p^{0}、d^{0}、f^{0}$
如$_{24}Cr$的电子排布式为17
(1)含义:基态原子中,填入简并轨道的电子总是先15
单独分占
不同的轨道,且自旋平行
。(2)补充内容:在简并轨道上的电子排布处于全充满、半充满和全空状态时,具有较低的能量和较强的稳定性。
全充满:$p^{6}、d^{10}、f^{14}$
相对稳定的状态 半充满:$p^{3}、d^{5}、f^{7}$
全空:$p^{0}、d^{0}、f^{0}$
如$_{24}Cr$的电子排布式为17
$1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}3d^{5}4s^{1}$
,易错写为$1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}3d^{4}4s^{2}$。
答案:
⑮单独分占;⑯平行;⑰$1s^{2}2s^{2}2p^{6}3s^{2}3p^{6}3d^{5}4s^{1}$
4.能量最低原理
(1)含义:在构建基态原子时,电子将尽可能地占据能量
(2)决定因素:整个原子的能量由
(1)含义:在构建基态原子时,电子将尽可能地占据能量
最低
的原子轨道,使整个原子的能量最低
。(2)决定因素:整个原子的能量由
核电荷数
、电子数
和电子状态
三个因素共同决定。
答案:
⑱最低;⑲最低;⑳核电荷数;㉑电子数;㉒电子状态
(1)为什么基态氦原子的电子排布是$1s^{2}而不是1s^{1}2s^{1}$?
在构建基态原子时,电子将尽可能地占据能量最低的原子轨道,使整个原子的能量最低,2s轨道的能量高于1s轨道,故应先填充满1s轨道,氦原子只有两个电子,电子排布为$1s^{2}$时能量最低。
答案:
在构建基态原子时,电子将尽可能地占据能量最低的原子轨道,使整个原子的能量最低,2s轨道的能量高于1s轨道,故应先填充满1s轨道,氦原子只有两个电子,电子排布为$1s^{2}$时能量最低。
(2)指出下列核外电子排布的书写分别违背了什么原则?
①$2p$轨道上有3个电子的原子:$\uparrow\downarrow\uparrow$
②基态P原子:$1s^{2}2s^{2}2p^{6}3s^{2}3p_{x}^{2}3p_{z}^{1}$
③$4s$轨道上有2个电子的原子:$\uparrow\uparrow$
④$3d$轨道上有8个电子的原子:$\uparrow\downarrow\uparrow\downarrow\uparrow\downarrow\uparrow\downarrow$
①$2p$轨道上有3个电子的原子:$\uparrow\downarrow\uparrow$
②基态P原子:$1s^{2}2s^{2}2p^{6}3s^{2}3p_{x}^{2}3p_{z}^{1}$
③$4s$轨道上有2个电子的原子:$\uparrow\uparrow$
④$3d$轨道上有8个电子的原子:$\uparrow\downarrow\uparrow\downarrow\uparrow\downarrow\uparrow\downarrow$
①②④违背了洪特规则;③违背了泡利原理。
答案:
①②④违背了洪特规则;③违背了泡利原理。
查看更多完整答案,请扫码查看


