2025年新坐标同步练习高中化学选择性必修第二册人教版青海专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年新坐标同步练习高中化学选择性必修第二册人教版青海专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第50页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
例 3(2023 • 山东卷)
$ClO_2 $中心原子为$ Cl,Cl_2O $中心原子为 O,二者均为 V 形结构,但$ ClO_2 $中存在大 π 键$(Π_3^5)。$$ClO_2 $中 Cl 原子的轨道杂化方式为
$ClO_2 $中心原子为$ Cl,Cl_2O $中心原子为 O,二者均为 V 形结构,但$ ClO_2 $中存在大 π 键$(Π_3^5)。$$ClO_2 $中 Cl 原子的轨道杂化方式为
sp²
;O - Cl - O 键角>
(填“>”“<”或“=”)Cl - O - Cl 键角。比较$ ClO_2 $与$ Cl_2O $中 Cl - O 的键长并说明原因:键长:ClO₂<Cl₂O,ClO₂分子中Cl-O键既含σ键又含大π键,键级较大,Cl₂O分子中Cl-O键仅为σ键,键级较小
。
答案:
sp² > 键长:ClO₂<Cl₂O,ClO₂分子中Cl-O键既含σ键又含大π键,键级较大,Cl₂O分子中Cl-O键仅为σ键,键级较小
1. 甘氨酸$(H_2NCH_2COOH)$是人体非必需的一种氨基酸。下列有关甘氨酸的说法错误的是(
A.分子中 σ 键与 π 键数目之比为 8 : 1
B.碳原子的杂化轨道类型是$ sp^3 $和$ sp^2$
C.分子间可以形成不止 3 种类型的氢键
D.易溶于极性溶剂,难溶于非极性溶剂
A
)A.分子中 σ 键与 π 键数目之比为 8 : 1
B.碳原子的杂化轨道类型是$ sp^3 $和$ sp^2$
C.分子间可以形成不止 3 种类型的氢键
D.易溶于极性溶剂,难溶于非极性溶剂
答案:
解析:选A。甘氨酸分子中σ键与π键数目之比为9∶1,故A错误;碳原子形成4个单键时,价层电子对数为4,采取sp³杂化,碳原子形成2个单键和1个双键时,价层电子对数为3,采取sp²杂化,故B正确;氨基中的氢原子可以与另一甘氨酸分子中氨基上的氮原子、羧基上的两个氧原子分别形成氢键,羧基中的氢原子可以分别与另一甘氨酸分子中氨基上的氮原子、羧基上的两个氧原子分别形成氢键,故分子间可以形成不止3种类型的氢键,故C正确。
2. 理论化学模拟得到一种 $[\begin{array}{c}\ddot{N}= N= \ddot{N}\\ \ddot{N}= \ddot{N}= \ddot{N}\end{array} ]\overset{+}{N}_{13}$,结构如右图所示。下列关于该离子的说法错误的是(
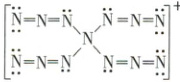
A.所有原子均满足 8 电子结构
B.N 原子的杂化方式有 2 种
C.空间结构为四面体形
D.常温下不稳定
B
)
A.所有原子均满足 8 电子结构
B.N 原子的杂化方式有 2 种
C.空间结构为四面体形
D.常温下不稳定
答案:
解析:选B。由N₁₃⁺的结构式可知,所有N原子均满足8电子结构,A正确;中心N原子为sp³杂化,与中心N原子直接相连的N原子为sp²杂化,与端位N原子直接相连的N原子为sp杂化,端位N原子为sp²杂化,故N原子的杂化方式有3种,B错误;中心N原子为sp³杂化,N₁₃⁺的空间结构为四面体形,C正确;N₁₃⁺中含有—N=N=N结构,类比叠氮物质可知,N₁₃⁺在常温下不稳定,D正确。
$3. CO_2 $和$ H_2 $制备乙醇发生的反应为$ 2CO_2 + 6H_2 = = CH_3CH_2OH + 3H_2O,$副产物可能有$ CH_4、$$CH_2 = CH_2 $或$ CH_3OH $等。下列说法错误的是(
$A. CH_2 = CH_2 $分子中 σ 键和 π 键数目之比为 5 : 1
$B. CH_4 $的键角比$ H_2O $的大
$C. CH_3CH_2OH $和$ CH_3OH $均为极性分子
D. 上述含碳物质中碳原子的杂化方式有 2 种
D
)$A. CH_2 = CH_2 $分子中 σ 键和 π 键数目之比为 5 : 1
$B. CH_4 $的键角比$ H_2O $的大
$C. CH_3CH_2OH $和$ CH_3OH $均为极性分子
D. 上述含碳物质中碳原子的杂化方式有 2 种
答案:
解析:选D。碳碳双键中有1个σ键和1个π键,单键均为σ键,故CH₂=CH₂分子中σ键和π键数目之比为5∶1,A正确。CH₄中心C原子孤电子对数为(4 - 1×4)/2 = 0、价层电子对数为4,故为sp³杂化,空间结构为正四面体形;H₂O中心O原子孤电子对数为(6 - 1×2)/2 = 2、价层电子对数为4,故为sp³杂化,空间结构为V形,孤电子对和σ键电子对之间的排斥力大于σ键电子对之间的排斥力,故CH₄的键角比H₂O的大,B正确。CH₃CH₂OH和CH₃OH分子结构均不对称,均为极性分子,C正确。CO₂中碳原子为sp杂化,CH₂=CH₂中碳原子为sp²杂化,CH₃CH₂OH、CH₃OH中碳原子均为sp³杂化,故碳原子的杂化方式有3种,D错误。
4. 磷酸聚合可以生成链状多磷酸和环状多磷酸,三分子磷酸聚合形成的链状三磷酸结构如下图所示。下列说法正确的是( )
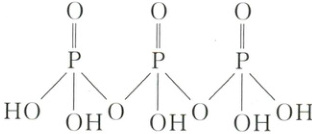
A.键能:P - O > P = O
B.元素的电负性:P > O > H
$C.PO_4^3⁻ $的空间结构为平面四边形
D.六元环状三磷酸的分子式为$ H_3P_3O_9$

A.键能:P - O > P = O
B.元素的电负性:P > O > H
$C.PO_4^3⁻ $的空间结构为平面四边形
D.六元环状三磷酸的分子式为$ H_3P_3O_9$
答案:
解析:选D。键能:双键>单键,故键能:P—O<P=O,A错误;同周期主族元素从左到右,元素电负性逐渐变大,同主族元素从上到下,元素电负性逐渐变小,故电负性:O>P>H,B错误;PO₄³⁻的中心P原子的价层电子对数为4+(5 + 3 - 2×4)/2 = 4,无孤电子对,故PO₄³⁻的空间结构为正四面体形,C错误;六元环状三磷酸的结构为 ,故分子式为H₃P₃O₉,D 正确。
,故分子式为H₃P₃O₉,D 正确。
解析:选D。键能:双键>单键,故键能:P—O<P=O,A错误;同周期主族元素从左到右,元素电负性逐渐变大,同主族元素从上到下,元素电负性逐渐变小,故电负性:O>P>H,B错误;PO₄³⁻的中心P原子的价层电子对数为4+(5 + 3 - 2×4)/2 = 4,无孤电子对,故PO₄³⁻的空间结构为正四面体形,C错误;六元环状三磷酸的结构为
 ,故分子式为H₃P₃O₉,D 正确。
,故分子式为H₃P₃O₉,D 正确。 5. (2023 • 重庆卷$)NCl_3 $和$ SiCl_4 $均可发生水解反应,其中$ NCl_3 $的水解机理示意图如下:
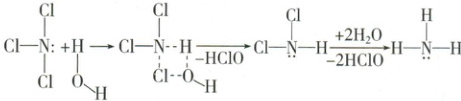
下列说法正确的是( )
$A. NCl_3 $和$ SiCl_4 $均为极性分子
$B. NCl_3 $和$ NH_3 $中的 N 均为$ sp^2 $杂化
$C. NCl_3 $和$ SiCl_4 $的水解反应机理相同
$D. NHCl_2 $和$ NH_3 $均能与$ H_2O $形成氢键

下列说法正确的是( )
$A. NCl_3 $和$ SiCl_4 $均为极性分子
$B. NCl_3 $和$ NH_3 $中的 N 均为$ sp^2 $杂化
$C. NCl_3 $和$ SiCl_4 $的水解反应机理相同
$D. NHCl_2 $和$ NH_3 $均能与$ H_2O $形成氢键
答案:
解析:选D。NCl₃的中心N原子的价层电子对数为3+(1/2)(5 - 3×1)=4,空间结构为三角锥形,分子中正电中心和负电中心不重合,为极性分子,而SiCl₄的中心Si 原子的价层电子对数为4+(1/2)(4 - 4×1)=4,空间结构为正四面体形,分子中正电中心和负电中心重合,为非极性分子,A错误;NCl₃和NH₃的中心N原子的价层电子对数均为4,故二者中的N均为sp³杂化,B错误;SiCl₄的水解反应机理为

 ,与NCl₃的水解机理不同,C错误;NH₂Cl和NH₃分子中均存在N—H和孤电子对,故均能与H₂O形成氢键,D正确。
,与NCl₃的水解机理不同,C错误;NH₂Cl和NH₃分子中均存在N—H和孤电子对,故均能与H₂O形成氢键,D正确。
解析:选D。NCl₃的中心N原子的价层电子对数为3+(1/2)(5 - 3×1)=4,空间结构为三角锥形,分子中正电中心和负电中心不重合,为极性分子,而SiCl₄的中心Si 原子的价层电子对数为4+(1/2)(4 - 4×1)=4,空间结构为正四面体形,分子中正电中心和负电中心重合,为非极性分子,A错误;NCl₃和NH₃的中心N原子的价层电子对数均为4,故二者中的N均为sp³杂化,B错误;SiCl₄的水解反应机理为

 ,与NCl₃的水解机理不同,C错误;NH₂Cl和NH₃分子中均存在N—H和孤电子对,故均能与H₂O形成氢键,D正确。
,与NCl₃的水解机理不同,C错误;NH₂Cl和NH₃分子中均存在N—H和孤电子对,故均能与H₂O形成氢键,D正确。 6. (1)已知吡啶( )中含有与苯类似的$ Π_6^6 $大 π 键,则吡啶中 N 原子的价层孤电子对占据_________(填字母)。
)中含有与苯类似的$ Π_6^6 $大 π 键,则吡啶中 N 原子的价层孤电子对占据_________(填字母)。
A. 2s 轨道
B. 2p 轨道
C. sp 杂化轨道
$D. sp^2 $杂化轨道
(2)吡啶在水中的溶解度远大于苯在水中的溶解度,主要原因是①_________,②_________。
(3)、、 的碱性随 N 原子电子云密度的增大而增强,其中碱性最弱的是_________。
的碱性随 N 原子电子云密度的增大而增强,其中碱性最弱的是_________。
 )中含有与苯类似的$ Π_6^6 $大 π 键,则吡啶中 N 原子的价层孤电子对占据_________(填字母)。
)中含有与苯类似的$ Π_6^6 $大 π 键,则吡啶中 N 原子的价层孤电子对占据_________(填字母)。A. 2s 轨道
B. 2p 轨道
C. sp 杂化轨道
$D. sp^2 $杂化轨道
(2)吡啶在水中的溶解度远大于苯在水中的溶解度,主要原因是①_________,②_________。
(3)、、
 的碱性随 N 原子电子云密度的增大而增强,其中碱性最弱的是_________。
的碱性随 N 原子电子云密度的增大而增强,其中碱性最弱的是_________。
答案:
(1)D
(2)吡啶能与H₂O分子形成分子间氢键,吡啶和H₂O均为极性分子,而苯为非极性分子。
(3)
(1)D
(2)吡啶能与H₂O分子形成分子间氢键,吡啶和H₂O均为极性分子,而苯为非极性分子。
(3)

查看更多完整答案,请扫码查看


