2025年新坐标同步练习高中化学选择性必修第二册人教版青海专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年新坐标同步练习高中化学选择性必修第二册人教版青海专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第42页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
1.下列与氢原子形成的极性键最强的原子是(
A.F
B.Cl
C.Br
D.P
A
)A.F
B.Cl
C.Br
D.P
答案:
解析:选A。成键的两原子的电负性差值越大,键的极性越强,F的电负性最大,与氢原子形成的极性键最强。
2.(2025·泰安高二检测)下列分子属于非极性分子的是(
A.$CH_2Cl_2$
B.$CS_2$
C.$NCl_3$
D.$H_2S$
B
)A.$CH_2Cl_2$
B.$CS_2$
C.$NCl_3$
D.$H_2S$
答案:
解析:选B。CH₂Cl₂中含有极性键,空间结构为四面体形,正电中心和负电中心不重合,为极性分子,故A不符合题意;CS₂中含有极性键,空间结构为直线形,正电中心和负电中心重合,为非极性分子,故B符合题意;NCl₃中含有极性键,空间结构为三角锥形,正电中心和负电中心不重合,为极性分子,故C不符合题意;H₂S中含有极性键,空间结构为V形,正电中心和负电中心不重合,为极性分子,故D不符合题意。
3.(教材习题改编)下列各组物质中,属于由极性键构成的极性分子的是(
A.$CH_4和Br_2$
B.$NH_3和H_2O$
C.$BF_3和CO_2$
D.$BeCl_2和HCl$
B
)A.$CH_4和Br_2$
B.$NH_3和H_2O$
C.$BF_3和CO_2$
D.$BeCl_2和HCl$
答案:
解析:选B。CH₄是由极性键构成的非极性分子,Br₂是由非极性键构成的非极性分子,故A不符合题意;NH₃和H₂O都是由极性键构成的极性分子,故B符合题意;BF₃和CO₂都是由极性键构成的非极性分子,故C不符合题意;BeCl₂是由极性键构成的非极性分子,HCl是由极性键构成的极性分子,故D不符合题意。
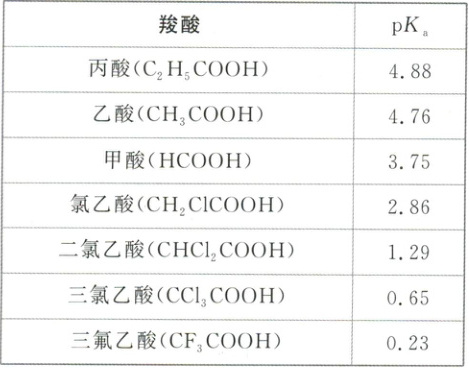
羧酸的酸性大小与其分子的组成和结构有关,羧酸的酸性可用$pK_a$($pK_a = -\lg K_a$)的大小来衡量,$pK_a$越小,酸性越强。根据下表,回答有关问题:

答案:
羧酸的酸性随羧基相连基团吸电子能力增强而增强,随推电子能力增强而减弱。
1.甲酸和乙酸哪个酸性强?原因是什么?
酸性:甲酸>乙酸,原因是烷基(R—)是推电子基团,烷基越长推电子效应越大,使羧基中的羟基的极性越小,羧酸的酸性越弱。
答案:
酸性:甲酸>乙酸,原因是烷基(R—)是推电子基团,烷基越长推电子效应越大,使羧基中的羟基的极性越小,羧酸的酸性越弱。
2.三氟乙酸的酸性远强于乙酸的原因是什么?
由于F的电负性较大,—CF₃是吸电子基团,使羧基中羟基的极性更大,更易电离出H⁺。
答案:
由于F的电负性较大,—CF₃是吸电子基团,使羧基中羟基的极性更大,更易电离出H⁺。
3.三氟乙酸和三氯乙酸哪个酸性强?原因是什么?
酸性:三氟乙酸>三氯乙酸,原因是氟的电负性大于氯的电负性,F—C的极性大于Cl—C的极性,使F₃C—的极性大于Cl₃C—的极性,导致三氟乙酸的羧基中的羟基的极性更大,更易电离出H⁺。
答案:
酸性:三氟乙酸>三氯乙酸,原因是氟的电负性大于氯的电负性,F—C的极性大于Cl—C的极性,使F₃C—的极性大于Cl₃C—的极性,导致三氟乙酸的羧基中的羟基的极性更大,更易电离出H⁺。
1.下列物质中,酸性最强的是(
A.$CH_2ClCOOH$
B.$CH_2FCOOH$
C.$CHF_2COOH$
D.$CHBr_2COOH$
C
)A.$CH_2ClCOOH$
B.$CH_2FCOOH$
C.$CHF_2COOH$
D.$CHBr_2COOH$
答案:
解析:选C。电负性:F>Cl>Br,故酸性最强的是CHF₂COOH。
查看更多完整答案,请扫码查看


