2025年新坐标同步练习高中化学选择性必修第二册人教版青海专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年新坐标同步练习高中化学选择性必修第二册人教版青海专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第25页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
1. 共价键的形成
(1) 概念:原子间通过①
(2) 成键微粒:一般为②
(3) 本质:原子间通过原子轨道重叠产生的强烈作用。
(1) 概念:原子间通过①
共用电子对
所形成的相互作用。(2) 成键微粒:一般为②
非金属
原子(相同或不相同)或金属原子与非金属原子。(3) 本质:原子间通过原子轨道重叠产生的强烈作用。
答案:
(1)①共用电子对
(2)②非金属
(3)
(1)①共用电子对
(2)②非金属
(3)
2. 共价键的特征
(1) 饱和性:根据共价键的定义,一个原子有几个未成对电子,便可和几个自旋相反的电子配对成键。饱和性决定分子的组成。
学思用 1. $NH_3$分子中为什么N原子的个数是1个,而H原子的个数是3个?
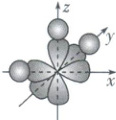
(2) 方向性:除s轨道是③
学思用 2. 为什么水分子中的三个原子不在一条直线上?
(1) 饱和性:根据共价键的定义,一个原子有几个未成对电子,便可和几个自旋相反的电子配对成键。饱和性决定分子的组成。
学思用 1. $NH_3$分子中为什么N原子的个数是1个,而H原子的个数是3个?
(2) 方向性:除s轨道是③
球形
对称外,其他原子轨道在空间排布上都具有一定的分布特点。在形成共价键时,原子轨道重叠得越④多
,电子在核间出现的概率越大,所形成的共价键就越牢固,因此共价键将尽可能沿着电子出现概率最大的方向形成,如s轨道与p轨道相互重叠形成共价键的方式如上图所示。方向性决定分子的空间结构。
学思用 2. 为什么水分子中的三个原子不在一条直线上?
答案:
(2)③球形 ④多
(2)③球形 ④多
3. 形成条件
从电负性的角度理解共价键、离子键的形成条件。
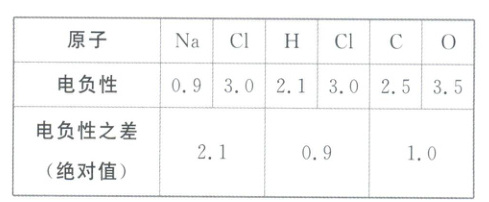
结论:当元素的电负性相差很大,化学反应形成的电子对不会被共用,形成的将是⑤
从电负性的角度理解共价键、离子键的形成条件。

结论:当元素的电负性相差很大,化学反应形成的电子对不会被共用,形成的将是⑤
离子
键;而⑥共价
键是元素的电负性相差不大的原子之间形成的化学键。
答案:
⑤离子 ⑥共价
查看更多完整答案,请扫码查看


