2025年新坐标同步练习高中化学选择性必修第二册人教版青海专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年新坐标同步练习高中化学选择性必修第二册人教版青海专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第31页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
1. 关于键角,下列说法不正确的是(
A.键角的大小与键长、键能的大小有关
B.分子中的键角:$CO_2 > H_2O$
C.键角是描述分子空间结构的重要参数
D.多原子分子的键角一定,表明共价键具有方向性
A
)A.键角的大小与键长、键能的大小有关
B.分子中的键角:$CO_2 > H_2O$
C.键角是描述分子空间结构的重要参数
D.多原子分子的键角一定,表明共价键具有方向性
答案:
解析:选 A。键角的大小取决于成键原子轨道的夹角,与键长、键能的大小无关,A 不正确;CO₂分子为直线形,键角为 180°,H₂O 分子为 V 形,键角为 105°,故键角:CO₂>H₂O,B 正确;键长和键角常被用来描述分子的空间结构,键角是描述分子空间结构的重要参数,C 正确;多原子分子的键角一定,表明共价键具有方向性,D 正确。
2. 能说明$BF_3$分子中的4个原子在同一平面的理由是(
A.B—F之间的夹角为120°
B.B—F为σ键
C.3个B—F的键能相同
D.3个B—F的键长相等
A
)A.B—F之间的夹角为120°
B.B—F为σ键
C.3个B—F的键能相同
D.3个B—F的键长相等
答案:
解析:选 A。A 项,B—F 之间的夹角为 120°,3 个 B—F 的夹角和为 360°,能证明 BF₃是平面结构,说明 BF₃分子中的 4 个原子在同一平面;B 项,B—F 为 σ 键即为共价单键,不能证明 BF₃为平面结构,即不能证明 BF₃分子中的 4 个原子在同一平面;C 项,3 个 B—F 的键能相同,不能证明 BF₃为平面结构,即不能证明 BF₃分子中的 4 个原子在同一平面;D 项,3 个 B—F 的键长相等,不能证明 BF₃为平面结构,即不能证明 BF₃分子中的 4 个原子在同一平面。
3. (2025·海口高二检测)分子的中心原子相同时,周围原子电负性大者键角小。$NH_3、$$NF_3、$$NCl_3$三种分子中,键角由大到小的顺序是(
$A. NH_3 > NF_3 > NCl_3$
$B. NCl_3 > NF_3 > NH_3$
$C. NH_3 > NCl_3 > NF_3$
$D. NF_3 > NCl_3 > NH_3$
C
)$A. NH_3 > NF_3 > NCl_3$
$B. NCl_3 > NF_3 > NH_3$
$C. NH_3 > NCl_3 > NF_3$
$D. NF_3 > NCl_3 > NH_3$
答案:
解析:选 C。电负性:F>Cl>H,结合题给信息可知,键角由大到小的顺序为 NH₃>NCl₃>NF₃。
1. 下列事实不能用键能的大小来解释的是(
A.氮元素的电负性较大,但$N_2$的化学性质很稳定
B.稀有气体一般难发生反应
C.HF、HCl、HBr、HI的稳定性依次减弱
D.HF比$H_2O$稳定
B
)A.氮元素的电负性较大,但$N_2$的化学性质很稳定
B.稀有气体一般难发生反应
C.HF、HCl、HBr、HI的稳定性依次减弱
D.HF比$H_2O$稳定
答案:
解析:选 B。A 项,由于 N₂分子中存在 N≡N,键能很大,破坏共价键需要很高的能量,因此 N₂的化学性质很稳定;B 项,稀有气体都为单原子分子,没有化学键;C 项,卤族元素从 F 到 I,原子半径逐渐增大,其氢化物中共价键的键长逐渐变长,键能逐渐变小,稳定性逐渐减弱;D 项,由于 H—F 的键能大于 H—O 的键能,因此 HF 比 H₂O 稳定。
2. 三氯化磷分子的空间结构是三角锥形。下列关于三氯化磷分子的叙述不正确的是(
$A. PCl_3$分子中三个共价键的键长相等
$B. PCl_3$分子中的P—Cl属于σ键
$C. PCl_3$分子中三个共价键的键能相等
$D. PCl_3$分子中三个共价键的夹角均为120°
D
)$A. PCl_3$分子中三个共价键的键长相等
$B. PCl_3$分子中的P—Cl属于σ键
$C. PCl_3$分子中三个共价键的键能相等
$D. PCl_3$分子中三个共价键的夹角均为120°
答案:
解析:选 D。三氯化磷分子的空间结构是三角锥形,说明 PCl₃分子中三个共价键的夹角均不是 120°。
3. 对比下列几个反应式:
$Cl(g) + Cl(g) → Cl_2(g) ΔH_1 = - 242.7 kJ·mol⁻^1;$
$O(g) + O(g) → O_2(g) ΔH_2 = - 497.3 kJ·mol⁻^1;$
$N(g) + N(g) → N_2(g) ΔH_3 = - 946 kJ·mol⁻^1。$
可以得出的结论是(
A.常温下氯气比氧气和氮气稳定
B.氮、氧和氯的单质在常温下均为气体
C.O = O的键能为$497.3 kJ·mol⁻^1$
D.氮气、氧气和氯气的密度不同
$Cl(g) + Cl(g) → Cl_2(g) ΔH_1 = - 242.7 kJ·mol⁻^1;$
$O(g) + O(g) → O_2(g) ΔH_2 = - 497.3 kJ·mol⁻^1;$
$N(g) + N(g) → N_2(g) ΔH_3 = - 946 kJ·mol⁻^1。$
可以得出的结论是(
C
)A.常温下氯气比氧气和氮气稳定
B.氮、氧和氯的单质在常温下均为气体
C.O = O的键能为$497.3 kJ·mol⁻^1$
D.氮气、氧气和氯气的密度不同
答案:
解析:选 C。成键释放的能量越多,表示形成的共价键越牢固,分子越稳定,ΔH₃最小,故常温下氮气最稳定,A 错误;常温下三种单质均为气体,但与题述反应式无关,B 错误;由键能的定义,结合题述反应式可知,O=O 的键能为 497.3 kJ·mol⁻¹,C 正确;三种气体的密度不同,但与题述反应式无关,D 错误。
4. 下列有关共价键的键参数的比较不正确的是(
A.键长:C—C > C = C > C≡C
B.键能:Br—Br < Cl—Cl < F—F
C.分子中的键角:$H_2O < CH_4$
D.乙烯分子中碳碳键的键能:σ键 > π键
B
)A.键长:C—C > C = C > C≡C
B.键能:Br—Br < Cl—Cl < F—F
C.分子中的键角:$H_2O < CH_4$
D.乙烯分子中碳碳键的键能:σ键 > π键
答案:
解析:选 B。一般化学键的键长越长键能越小,键能:C—C<C=C<C≡C,因此键长:C—C>C=C>C≡C,A 正确;F 原子半径小,F₂分子内两个氟原子间距近、键长短,同种电荷排斥力大,键能:F—F<Cl—Cl,B 错误;H₂O 分子中的键角为 105°,CH₄分子中的键角为 109°28',故分子中的键角:H₂O<CH₄,C 正确;σ 键为原子轨道“头碰头”重叠形成的,强度大,π 键为原子轨道“肩并肩”重叠形成的,强度小,故乙烯分子中碳碳键的键能:σ 键>π 键,D 正确。
5. 氢气分子形成过程的示意图如下,请回答相关问题。
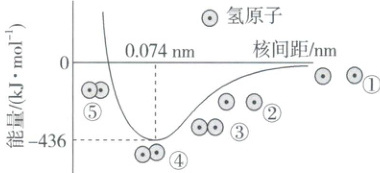
(1) H—H的键长为
(2) 下列说法正确的是
A. 氢气分子中含有一个π键
B. 由①到④,电子在核间出现的概率增大
C. 由④到⑤,必须消耗外界的能量
(3) 几种常见化学键的键能(单位为$kJ·mol⁻^1)$见下表:

① 试比较Si—C与Si—Si的键能大小:$x kJ·mol⁻^1$
② H₂被喻为“21世纪人类最理想的燃料”,而有科学家提出硅是“21世纪的能源”“未来的石油”等观点。试计算1 kg H₂燃烧生成水蒸气放出的热量约为

(1) H—H的键长为
0.074 nm
,①~⑤中,体系能量由高到低的顺序是①>⑤>②>③>④
。(2) 下列说法正确的是
BC
(填字母)。A. 氢气分子中含有一个π键
B. 由①到④,电子在核间出现的概率增大
C. 由④到⑤,必须消耗外界的能量
(3) 几种常见化学键的键能(单位为$kJ·mol⁻^1)$见下表:

① 试比较Si—C与Si—Si的键能大小:$x kJ·mol⁻^1$
>
(填“>”“<”或“=”)226 kJ·mol⁻¹。② H₂被喻为“21世纪人类最理想的燃料”,而有科学家提出硅是“21世纪的能源”“未来的石油”等观点。试计算1 kg H₂燃烧生成水蒸气放出的热量约为
1.2×10⁵ kJ
;每摩尔硅完全燃烧放出的热量约为858.7 kJ
(已知1 mol Si中含2 mol Si—Si,1 mol SiO₂中含4 mol Si—O)。
答案:
(1)由题图可知,H—H 的键长为 0.074 nm;体系能量由高到低的顺序是①>⑤>②>③>④。
(2)氢气分子中不含 π 键,A 项错误;共价键的本质就是高概率地出现在原子核间的电子与原子核间的电性作用,B 项正确;④已经达到稳定状态,由题图可知,⑤的能量比④的高,故由④到⑤,必须消耗外界的能量,C 项正确。
(3)①因为 Si—Si 的键长比 Si—C 的键长长,所以 Si—Si 的键能比 Si—C 的键能小。②由题图可知,H—H 的键能为 436 kJ·mol⁻¹,由 H₂(g)+$\frac{1}{2}$O₂(g)===H₂O(g)可得,1 mol H₂燃烧生成水蒸气放出的热量约为 462.8 kJ·mol⁻¹×2 mol-436 kJ·mol⁻¹×1 mol-497.3 kJ·mol⁻¹×$\frac{1}{2}$ mol=240.95 kJ,故 1 kg H₂燃烧生成水蒸气放出的热量约为$\frac{1×10^{3}g}{2g·mol^{-1}}$×240.95 kJ·mol⁻¹≈1.2×10⁵ kJ;Si(s)+O₂(g)===SiO₂(s),1 mol 硅完全燃烧放出的热量约为 452 kJ·mol⁻¹×4 mol-497.3 kJ·mol⁻¹×1 mol-226 kJ·mol⁻¹×2 mol=858.7 kJ。
(1)由题图可知,H—H 的键长为 0.074 nm;体系能量由高到低的顺序是①>⑤>②>③>④。
(2)氢气分子中不含 π 键,A 项错误;共价键的本质就是高概率地出现在原子核间的电子与原子核间的电性作用,B 项正确;④已经达到稳定状态,由题图可知,⑤的能量比④的高,故由④到⑤,必须消耗外界的能量,C 项正确。
(3)①因为 Si—Si 的键长比 Si—C 的键长长,所以 Si—Si 的键能比 Si—C 的键能小。②由题图可知,H—H 的键能为 436 kJ·mol⁻¹,由 H₂(g)+$\frac{1}{2}$O₂(g)===H₂O(g)可得,1 mol H₂燃烧生成水蒸气放出的热量约为 462.8 kJ·mol⁻¹×2 mol-436 kJ·mol⁻¹×1 mol-497.3 kJ·mol⁻¹×$\frac{1}{2}$ mol=240.95 kJ,故 1 kg H₂燃烧生成水蒸气放出的热量约为$\frac{1×10^{3}g}{2g·mol^{-1}}$×240.95 kJ·mol⁻¹≈1.2×10⁵ kJ;Si(s)+O₂(g)===SiO₂(s),1 mol 硅完全燃烧放出的热量约为 452 kJ·mol⁻¹×4 mol-497.3 kJ·mol⁻¹×1 mol-226 kJ·mol⁻¹×2 mol=858.7 kJ。
查看更多完整答案,请扫码查看


