2025年新坐标同步练习高中化学选择性必修第二册人教版青海专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年新坐标同步练习高中化学选择性必修第二册人教版青海专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第41页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
1.共价键的极性
(1)极性键和非极性键的比较

[说明]①根据元素电负性的大小能判断共价键中键合原子的电性。形成共价键的两个原子,电负性大的原子呈负电性(用$\delta-$表示),电负性小的原子呈正电性(用$\delta+$表示)。
②电负性差值越大的两原子形成的共价键的极性越强。
(2)极性键和非极性键的存在


(1)极性键和非极性键的比较

[说明]①根据元素电负性的大小能判断共价键中键合原子的电性。形成共价键的两个原子,电负性大的原子呈负电性(用$\delta-$表示),电负性小的原子呈正电性(用$\delta+$表示)。
②电负性差值越大的两原子形成的共价键的极性越强。
(2)极性键和非极性键的存在


①不同 ②同种 ③发生 ④不发生
答案:
①不同 ②同种 ③发生 ④不发生
2.分子的极性
(1)分子的极性
分子:
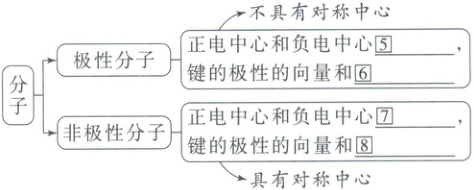
- 极性分子:不具有对称中心,正电中心和负电中心⑤
- 非极性分子:正电中心和负电中心⑦
(2)键的极性与分子的极性之间的关系
空间不对称:
- 极性分子:双原子分子,如$HCl$、$NO$、$HBr$等;V形分子,如$H_2O$、$H_2S$、$SO_2$等;三角锥形分子,如$NH_3$、$PH_3$等;四面体形分子,如$CHCl_3$、$CH_2Cl_2$等
- 非极性分子:单质分子,如$Cl_2$、$N_2$、$P_4$、$I_2$等;直线形分子,如$CO_2$、$CS_2$、$C_2H_2$等;平面正三角形分子,如$BF_3$、$SO_3$等;正四面体形分子,如$CH_4$、$CCl_4$、$CF_4$等

(1)分子的极性
分子:
- 极性分子:不具有对称中心,正电中心和负电中心⑤
不重合
,键的极性的向量和⑥不等于零
- 非极性分子:正电中心和负电中心⑦
重合
,键的极性的向量和⑧等于零
,具有对称中心
(2)键的极性与分子的极性之间的关系
空间不对称:
- 极性分子:双原子分子,如$HCl$、$NO$、$HBr$等;V形分子,如$H_2O$、$H_2S$、$SO_2$等;三角锥形分子,如$NH_3$、$PH_3$等;四面体形分子,如$CHCl_3$、$CH_2Cl_2$等
- 非极性分子:单质分子,如$Cl_2$、$N_2$、$P_4$、$I_2$等;直线形分子,如$CO_2$、$CS_2$、$C_2H_2$等;平面正三角形分子,如$BF_3$、$SO_3$等;正四面体形分子,如$CH_4$、$CCl_4$、$CF_4$等

答案:
⑤不重合 ⑥不等于零 ⑦重合 ⑧等于零
臭氧是极性分子还是非极性分子?从结构上如何理解?
臭氧是极性分子。臭氧分子的空间结构与水分子的相似,由于中心氧原子有1个孤电子对,孤电子对对成键电子对排斥力大,故臭氧分子中的共价键是极性键,中心氧原子呈正电性,端位的两个氧原子呈负电性,故其分子具有微弱的极性。
答案:
臭氧是极性分子。臭氧分子的空间结构与水分子的相似,由于中心氧原子有1个孤电子对,孤电子对对成键电子对排斥力大,故臭氧分子中的共价键是极性键,中心氧原子呈正电性,端位的两个氧原子呈负电性,故其分子具有微弱的极性。
[自我诊断]
(1)以非极性键结合的双原子分子一定是非极性分子(
(2)以极性键结合的分子一定是极性分子(
(3)非极性分子只能是双原子单质分子(
(4)非极性分子中,一定含有非极性共价键(
(5)由同种元素组成的单质一定是非极性分子(
(1)以非极性键结合的双原子分子一定是非极性分子(
√
)(2)以极性键结合的分子一定是极性分子(
×
)(3)非极性分子只能是双原子单质分子(
×
)(4)非极性分子中,一定含有非极性共价键(
×
)(5)由同种元素组成的单质一定是非极性分子(
×
)
答案:
(1)√
(2)×
(3)×
(4)×
(5)×
(1)√
(2)×
(3)×
(4)×
(5)×
查看更多完整答案,请扫码查看


