2025年新坐标同步练习高中化学选择性必修第二册人教版青海专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年新坐标同步练习高中化学选择性必修第二册人教版青海专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第17页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
1. 为什么第 ⅡA 族、ⅤA 族元素比同周期相邻元素的第一电离能大?
第ⅡA族元素和第ⅤA族元素原子的价层电子排布式分别为ns²全充满结构和ns²np³半充满结构,稳定性较高,故第一电离能出现反常。
答案:
第ⅡA族元素和第ⅤA族元素原子的价层电子排布式分别为ns²全充满结构和ns²np³半充满结构,稳定性较高,故第一电离能出现反常。
3. 电离能的应用
(1) 判断元素的金属性、非金属性强弱:一般来说,$ I_1 $ 越大,元素的非金属性越⑨
(2) 根据电离能数据确定元素原子核外电子的排布及元素的化合价,如 $ Li $:$ I_1 \ll I_2 < I_3 $,表明 $ Li $ 原子核外的三个电子排布在两个能层上(K、L 能层),且最外层上只有一个电子,易失去⑪
(1) 判断元素的金属性、非金属性强弱:一般来说,$ I_1 $ 越大,元素的非金属性越⑨
强
;$ I_1 $ 越小,元素的金属性越⑩强
。(2) 根据电离能数据确定元素原子核外电子的排布及元素的化合价,如 $ Li $:$ I_1 \ll I_2 < I_3 $,表明 $ Li $ 原子核外的三个电子排布在两个能层上(K、L 能层),且最外层上只有一个电子,易失去⑪
一个
电子形成⑫+1
价阳离子。
答案:
⑨强 ⑩强 ⑪一个 ⑫+1
2. 下表是第三周期部分元素的电离能 [单位:eV(电子伏特)] 数据,思考并回答下列问题。
(1) 四种元素中哪种元素的金属性最强?
(2) 甲、乙的价层电子排布式是什么?它们在化合物中的常见化合价是多少?
(3) 丁一定是非金属元素吗?试说明理由。
(1)甲元素的第一电离能最小,金属性最强。
(2)甲为Na元素,价层电子排布式3s¹,在化合物中的常见化合价为+1价;乙为Mg元素,价层电子排布式3s²,在化合物中的常见化合价为+2价。
(3)一定。第三周期有三种金属元素,甲、乙、丙、丁四种元素中,丁的I₁最大,一定是非金属元素。
(1) 四种元素中哪种元素的金属性最强?
(2) 甲、乙的价层电子排布式是什么?它们在化合物中的常见化合价是多少?
(3) 丁一定是非金属元素吗?试说明理由。
(1)甲元素的第一电离能最小,金属性最强。
(2)甲为Na元素,价层电子排布式3s¹,在化合物中的常见化合价为+1价;乙为Mg元素,价层电子排布式3s²,在化合物中的常见化合价为+2价。
(3)一定。第三周期有三种金属元素,甲、乙、丙、丁四种元素中,丁的I₁最大,一定是非金属元素。
答案:
(1)甲元素的第一电离能最小,金属性最强。
(2)甲为Na元素,价层电子排布式3s¹,在化合物中的常见化合价为+1价;乙为Mg元素,价层电子排布式3s²,在化合物中的常见化合价为+2价。
(3)一定。第三周期有三种金属元素,甲、乙、丙、丁四种元素中,丁的I₁最大,一定是非金属元素。
(1)甲元素的第一电离能最小,金属性最强。
(2)甲为Na元素,价层电子排布式3s¹,在化合物中的常见化合价为+1价;乙为Mg元素,价层电子排布式3s²,在化合物中的常见化合价为+2价。
(3)一定。第三周期有三种金属元素,甲、乙、丙、丁四种元素中,丁的I₁最大,一定是非金属元素。
自我诊断
(1) 第一电离能越大的原子失电子的能力越强 (
(2) 第三周期所含元素中钠的第一电离能最小 (
(3) 铝的第一电离能比镁的第一电离能大 (
(4) 在所有元素中,氟元素的第一电离能最大 (
(5) 第二周期中,$ I_1 $ 介于 N、B 之间的元素有 2 种 (
(6) 可通过一种元素各级电离能的数值,判断该元素可能的化合价 (
(1) 第一电离能越大的原子失电子的能力越强 (
×
)(2) 第三周期所含元素中钠的第一电离能最小 (
√
)(3) 铝的第一电离能比镁的第一电离能大 (
×
)(4) 在所有元素中,氟元素的第一电离能最大 (
×
)(5) 第二周期中,$ I_1 $ 介于 N、B 之间的元素有 2 种 (
×
)(6) 可通过一种元素各级电离能的数值,判断该元素可能的化合价 (
√
)
答案:
(1)×
(2)√
(3)×
(4)×
(5)×
(6)√
(1)×
(2)√
(3)×
(4)×
(5)×
(6)√
1. 下图表示前 18 号元素的原子序数和气态基态原子失去核外第一个电子所需能量的关系,其中 A、B、C 表示的元素分别是 (
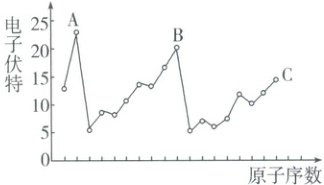
A.N、S、P
B.F、Cl、O
C.He、Ne、Ar
D.Si、C、B
C
)
A.N、S、P
B.F、Cl、O
C.He、Ne、Ar
D.Si、C、B
答案:
C
2. (教材习题改编) 下表为某短周期元素 R 的各级电离能数据(用 $ I_1 $、$ I_2 $、$ I_3 $、$ I_4 $、$ I_5 $... 表示,单位为 $ kJ \cdot mol^{-1} $)。下列关于元素 R 的判断不正确的是 (
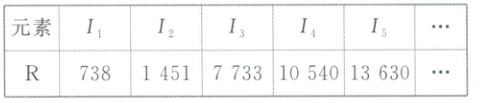
A.R 元素位于元素周期表的第 ⅡA 族
B.R 元素同周期相邻元素的第一电离能均小于 $ 738 kJ \cdot mol^{-1} $
C.R 元素位于元素周期表的 s 区
D.R 元素基态原子的电子排布式为 $ 1s^2 2s^2 2p^6 3s^2 3p^2 $
D
)
A.R 元素位于元素周期表的第 ⅡA 族
B.R 元素同周期相邻元素的第一电离能均小于 $ 738 kJ \cdot mol^{-1} $
C.R 元素位于元素周期表的 s 区
D.R 元素基态原子的电子排布式为 $ 1s^2 2s^2 2p^6 3s^2 3p^2 $
答案:
D
查看更多完整答案,请扫码查看


