2025年新坐标同步练习高中化学选择性必修第二册人教版青海专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年新坐标同步练习高中化学选择性必修第二册人教版青海专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第34页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
(1)四原子分子的空间结构都是平面三角形或三角锥形吗?
不是。
1. 四原子分子多为AX₃型(1个中心原子,3个配位原子),中心原子价层电子对数为3且无孤电子对时为平面三角形(如BF₃);价层电子对数为4且有1个孤电子对时为三角锥形(如NH₃)。
2. 存在其他结构,如ClF₃(四原子分子),中心原子Cl价层电子对数为5(3个成键电子对,2个孤电子对),空间结构为T形,不属于平面三角形或三角锥形。
结论:四原子分子的空间结构不都是平面三角形或三角锥形。
不是。
1. 四原子分子多为AX₃型(1个中心原子,3个配位原子),中心原子价层电子对数为3且无孤电子对时为平面三角形(如BF₃);价层电子对数为4且有1个孤电子对时为三角锥形(如NH₃)。
2. 存在其他结构,如ClF₃(四原子分子),中心原子Cl价层电子对数为5(3个成键电子对,2个孤电子对),空间结构为T形,不属于平面三角形或三角锥形。
结论:四原子分子的空间结构不都是平面三角形或三角锥形。
答案:
不是。
1. 四原子分子多为AX₃型(1个中心原子,3个配位原子),中心原子价层电子对数为3且无孤电子对时为平面三角形(如BF₃);价层电子对数为4且有1个孤电子对时为三角锥形(如NH₃)。
2. 存在其他结构,如ClF₃(四原子分子),中心原子Cl价层电子对数为5(3个成键电子对,2个孤电子对),空间结构为T形,不属于平面三角形或三角锥形。
结论:四原子分子的空间结构不都是平面三角形或三角锥形。
1. 四原子分子多为AX₃型(1个中心原子,3个配位原子),中心原子价层电子对数为3且无孤电子对时为平面三角形(如BF₃);价层电子对数为4且有1个孤电子对时为三角锥形(如NH₃)。
2. 存在其他结构,如ClF₃(四原子分子),中心原子Cl价层电子对数为5(3个成键电子对,2个孤电子对),空间结构为T形,不属于平面三角形或三角锥形。
结论:四原子分子的空间结构不都是平面三角形或三角锥形。
(2)空间结构相同的分子,键角完全相同吗?
空间结构相同的分子,键角不一定完全相同。
例如:NH₃和PH₃,空间结构均为三角锥形,但NH₃的键角约为107°,PH₃的键角约为93.6°。
空间结构相同的分子,键角不一定完全相同。
例如:NH₃和PH₃,空间结构均为三角锥形,但NH₃的键角约为107°,PH₃的键角约为93.6°。
答案:
空间结构相同的分子,键角不一定完全相同。
例如:NH₃和PH₃,空间结构均为三角锥形,但NH₃的键角约为107°,PH₃的键角约为93.6°。
例如:NH₃和PH₃,空间结构均为三角锥形,但NH₃的键角约为107°,PH₃的键角约为93.6°。
自我诊断
(1)所有的三原子分子都是直线形结构(
(2)甲醛分子呈平面三角形,键角约120°(
(3)正四面体形分子一定是五原子分子(
(4)SiCl$_4$、SiH$_4$、NH$_4^+$、CH$_3$Cl均为正四面体形结构(
归纳总结
几种常见分子的空间结构
(1)直线形分子:BeCl$_2$、HCN、C$_2$H$_2$、CO$_2$等。
(2)V形分子:H$_2$O、H$_2$S、SO$_2$等。
(3)平面三角形分子:BF$_3$、SO$_3$、HCHO等。
(4)三角锥形分子:PH$_3$、PCl$_3$、NH$_3$等。
(5)正四面体形分子:CH$_4$、CCl$_4$、SiH$_4$、SiF$_4$等。
(6)四面体形分子:CH$_3$Cl、CH$_2$Cl$_2$等。
(1)所有的三原子分子都是直线形结构(
×
)(2)甲醛分子呈平面三角形,键角约120°(
√
)(3)正四面体形分子一定是五原子分子(
×
)(4)SiCl$_4$、SiH$_4$、NH$_4^+$、CH$_3$Cl均为正四面体形结构(
×
)归纳总结
几种常见分子的空间结构
(1)直线形分子:BeCl$_2$、HCN、C$_2$H$_2$、CO$_2$等。
(2)V形分子:H$_2$O、H$_2$S、SO$_2$等。
(3)平面三角形分子:BF$_3$、SO$_3$、HCHO等。
(4)三角锥形分子:PH$_3$、PCl$_3$、NH$_3$等。
(5)正四面体形分子:CH$_4$、CCl$_4$、SiH$_4$、SiF$_4$等。
(6)四面体形分子:CH$_3$Cl、CH$_2$Cl$_2$等。
答案:
(1)× 有些三原子分子如CO₂、BeCl₂等为直线形结构,有些三原子分子如H₂O、H₂S等为V形结构
(2)√
(3)× P₄的空间结构为正四面体形,是四原子分子
(4)×
(1)× 有些三原子分子如CO₂、BeCl₂等为直线形结构,有些三原子分子如H₂O、H₂S等为V形结构
(2)√
(3)× P₄的空间结构为正四面体形,是四原子分子
(4)×
1. 下列分子的空间结构模型正确的是(
A.CO$_2$的空间结构模型:(CO_2空间结构模型)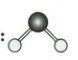
B.H$_2$O的空间结构模型:(H_2O空间结构模型)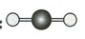
C.NH$_3$的空间结构模型:(NH_3空间结构模型)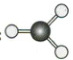
D.CH$_4$的空间结构模型:(CH_4空间结构模型)

D
)A.CO$_2$的空间结构模型:(CO_2空间结构模型)

B.H$_2$O的空间结构模型:(H_2O空间结构模型)

C.NH$_3$的空间结构模型:(NH_3空间结构模型)

D.CH$_4$的空间结构模型:(CH_4空间结构模型)

答案:
D
2. 下列分子中,按键角由大到小顺序排列是(
①BCl$_3$ ②NH$_3$ ③H$_2$O ④CH$_4$ ⑤BeCl$_2$
A.⑤④①②③
B.⑤①④②③
C.④①②⑤③
D.③②④①⑤
B
)①BCl$_3$ ②NH$_3$ ③H$_2$O ④CH$_4$ ⑤BeCl$_2$
A.⑤④①②③
B.⑤①④②③
C.④①②⑤③
D.③②④①⑤
答案:
B
3. 下列有关键角与分子空间结构的说法不正确的是(
A.键角为180°的分子,空间结构是直线形
B.键角为120°的分子,空间结构一定是平面三角形
C.键角为60°的分子,空间结构可能是正四面体形
D.键角为90°~109°28′之间的分子,空间结构可能是V形
B
)A.键角为180°的分子,空间结构是直线形
B.键角为120°的分子,空间结构一定是平面三角形
C.键角为60°的分子,空间结构可能是正四面体形
D.键角为90°~109°28′之间的分子,空间结构可能是V形
答案:
B
1. 理论要点
(1)分子或离子的空间结构是中心原子周围的“价层电子对”(包括成键的①
(2)价层电子对之间相互排斥力最小的空间结构,体系能量最低,最稳定。
(3)多重键只计其中的σ键电子对,不计π键电子对。
(1)分子或离子的空间结构是中心原子周围的“价层电子对”(包括成键的①
σ键电子对
和未成键的②孤电子对
)相互排斥的结果。(2)价层电子对之间相互排斥力最小的空间结构,体系能量最低,最稳定。
(3)多重键只计其中的σ键电子对,不计π键电子对。
答案:
①σ键电子对 ②孤电子对
2. 价层电子对数的计算
(1)中心原子上的价层电子对数= σ键电子对数+中心原子上的孤电子对数。
(2)σ键电子对数的计算
由化学式确定,即中心原子形成几个σ键,就有几个σ键电子对。如H₂O中的中心原子为O,O有③
(3)中心原子上的孤电子对数的计算
中心原子上的孤电子对数= $\frac{1}{2}(a - xb)$
①a为中心原子的价电子数。
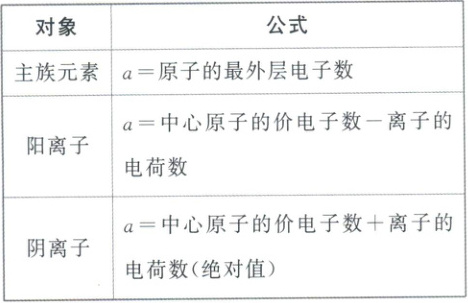
②x为与中心原子结合的原子数。
③b为与中心原子结合的原子最多能接受的电子数(氢为1,其他原子为“8减去该原子的价电子数”)。
例如,SO₂中的中心原子S上的孤电子对数= $\frac{1}{2}×(6 - 2×2)= 1$。
(1)中心原子上的价层电子对数= σ键电子对数+中心原子上的孤电子对数。
(2)σ键电子对数的计算
由化学式确定,即中心原子形成几个σ键,就有几个σ键电子对。如H₂O中的中心原子为O,O有③
2
个σ键电子对(O—H);NH₃中的中心原子为N,N有④3
个σ键电子对(N—H);SO₃有⑤3
个σ键电子对,SO₄²⁻有⑥4
个σ键电子对。(3)中心原子上的孤电子对数的计算
中心原子上的孤电子对数= $\frac{1}{2}(a - xb)$
①a为中心原子的价电子数。

②x为与中心原子结合的原子数。
③b为与中心原子结合的原子最多能接受的电子数(氢为1,其他原子为“8减去该原子的价电子数”)。
例如,SO₂中的中心原子S上的孤电子对数= $\frac{1}{2}×(6 - 2×2)= 1$。
答案:
③2 ④3 ⑤3 ⑥4
查看更多完整答案,请扫码查看


