2025年新坐标同步练习高中化学选择性必修第二册人教版青海专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年新坐标同步练习高中化学选择性必修第二册人教版青海专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第52页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
3. (2024·北京卷)${SnCl_{2}}和{SnCl_{4}}$是锡的常见氯化物,${SnCl_{2}}可被氧化得到{SnCl_{4}}$(如下图所示)。
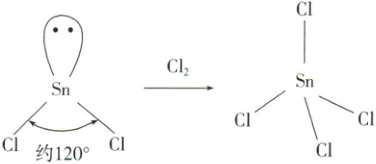
(1)${SnCl_{2}}$分子的 VSEPR 模型名称是
(2)${SnCl_{4}}的{Sn - Cl}$是由锡的

(1)${SnCl_{2}}$分子的 VSEPR 模型名称是
平面三角形
。(2)${SnCl_{4}}的{Sn - Cl}$是由锡的
sp³杂化
轨道与氯的 3p 轨道重叠形成$\sigma$键。
答案:
(1)平面三角形
(2)sp³杂化
(1)平面三角形
(2)sp³杂化
4. (2024·甘肃卷)温室气体${N_{2}O}在催化剂作用下可分解为{O_{2}}和{N_{2}}$。下列说法错误的是(
A.相同条件下${N_{2}}比{O_{2}}$稳定
B.${N_{2}O}与{NO^{+}_{2}}$的空间结构相同
C.${N_{2}O}中{N - O}比{N - N}$更易断裂
D.${N_{2}O}中\sigma键和大\pi$键的数目不相等
D
)A.相同条件下${N_{2}}比{O_{2}}$稳定
B.${N_{2}O}与{NO^{+}_{2}}$的空间结构相同
C.${N_{2}O}中{N - O}比{N - N}$更易断裂
D.${N_{2}O}中\sigma键和大\pi$键的数目不相等
答案:
解析:选D。N₂分子中存在键能较大的N≡N,故相同条件下N₂比O₂稳定,A项正确;N₂O与NO₂⁺的空间结构相同,均为直线形,B项正确;由题意可知,N₂O在催化剂作用下可分解为O₂和N₂,说明N₂O中N—O比N—N更易断裂,C项正确;N₂O的电子式为,则σ键和大π键的数目均为2,数目相等,D项错误。
5. (2023·北京卷)下列事实不能通过比较氟元素和氯元素的电负性进行解释的是(
A.${F - F}的键能小于{Cl - Cl}$的键能
B.三氟乙酸的$K_{a}大于三氯乙酸的K_{a}$
C.氟化氢分子的极性强于氯化氢分子的极性
D.气态氟化氢中存在${(HF)_{2}}$,而气态氯化氢中是${HCl}$分子
A
)A.${F - F}的键能小于{Cl - Cl}$的键能
B.三氟乙酸的$K_{a}大于三氯乙酸的K_{a}$
C.氟化氢分子的极性强于氯化氢分子的极性
D.气态氟化氢中存在${(HF)_{2}}$,而气态氯化氢中是${HCl}$分子
答案:
解析:选A。F原子半径小,电子云密度大,两个原子间的斥力较强,F—F不稳定,因此F—F的键能小于Cl—Cl的键能,与电负性无关,A符合题意;氟的电负性大于氯的电负性,F—C的极性大于Cl—C的极性,导致三氟乙酸的羧基中的羟基极性更大,更容易电离出氢离子,酸性更强,B不符合题意;氟的电负性大于氯的电负性,F—H的极性大于Cl—H的极性,导致HF分子的极性强于HCl,C不符合题意;氟的电负性大于氯的电负性,与氟原子相连的氢原子可以与另外的氟原子形成分子间氢键,因此气态氟化氢中存在(HF)₂,D不符合题意。
6. (2024·海南卷)过氧化脲${[CO(NH_{2})_{2}\cdot H_{2}O_{2}]}$是一种常用的消毒剂,可由过氧化氢${(H_{2}O_{2})}和脲{[CO(NH_{2})_{2}]}$加合而成,代表性结构如下图所示。下列关于过氧化脲的说法正确的是(
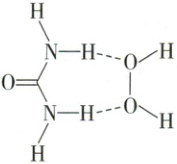
A.所有原子处于同一平面
B.氧的化合价均为$- 2$
C.杀菌能力源于其氧化性
D.所有共价键均为极性键
C
)
A.所有原子处于同一平面
B.氧的化合价均为$- 2$
C.杀菌能力源于其氧化性
D.所有共价键均为极性键
答案:
解析:选C。由题干物质结构式可知,分子中含有sp³杂化的O原子,故所有原子不可能处于同一平面,A错误;由题干物质结构式可知,分子中存在过氧键,其中氧的化合价为 - 1,其余氧的化合价为 - 2,B错误;该分子中存在过氧键,具有强氧化性,即杀菌能力源于其氧化性,C正确;过氧键为非极性键,其余共价键均为极性键,D错误。
7. (2024·湖南卷)通过理论计算方法优化了 P 和 Q 的分子结构,P 和 Q 呈平面六元并环结构,原子的连接方式如下图所示。下列说法错误的是(
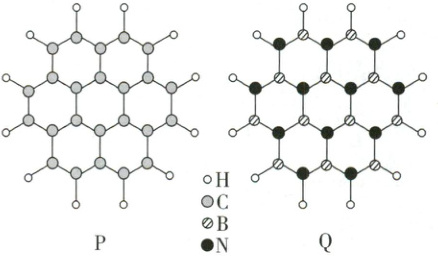
A.P 为非极性分子,Q 为极性分子
B.第一电离能:${B}<{C}<{N}$
C.$1\ mol\ P和1\ mol\ Q$所含电子数相等
D.P 和 Q 分子中 C、B 和 N 均为$sp^{2}$杂化
A
)
A.P 为非极性分子,Q 为极性分子
B.第一电离能:${B}<{C}<{N}$
C.$1\ mol\ P和1\ mol\ Q$所含电子数相等
D.P 和 Q 分子中 C、B 和 N 均为$sp^{2}$杂化
答案:
解析:选A。由题图可知,P和Q分子都满足正电中心和负电中心重合,都是非极性分子,A错误;同周期元素从左到右,第一电离能呈增大趋势,故第一电离能:B<C<N,B正确;由题图可知,P的分子式为C₂₄H₁₂,Q的分子式为B₁₂N₁₂H₂₄,P、Q分子都含有156个电子,故1mol P和1mol Q所含电子数相等,C正确;P和Q分子中C、B和N均与其他三个原子成键,P和Q分子呈平面结构,故P和Q分子中C、B和N均为sp²杂化,D正确。
查看更多完整答案,请扫码查看


