2025年新坐标同步练习高中化学选择性必修第二册人教版青海专版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年新坐标同步练习高中化学选择性必修第二册人教版青海专版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第44页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
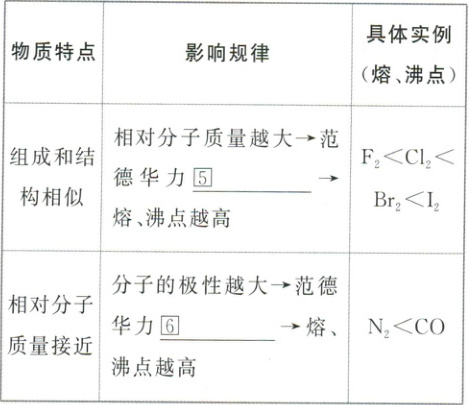
1. 范德华力及其对物质性质的影响
(1) 概念:分子之间存在着①
(2) 特征:范德华力很②
(3) 影响因素
① 一般来说,相对分子质量越大,范德华力③
② 分子的极性越大,范德华力④
(4) 对物质性质的影响
(1) 概念:分子之间存在着①
相互作用力
,把这类分子间作用力称为范德华力。(2) 特征:范德华力很②
弱
,比化学键的键能小1~2个数量级。(3) 影响因素
① 一般来说,相对分子质量越大,范德华力③
越大
。② 分子的极性越大,范德华力④
越大
。(4) 对物质性质的影响

答案:
①相互作用力 ②弱 ③越大 ④越大 ⑤越大 ⑥越大
2. 氢键及其对物质性质的影响
(1) 概念:由已经与⑦
(2) 表示方法:氢键通常用X—H…Y—表示,其中X、Y为⑨
(3) 特征
① 氢键不是化学键,而是一种较弱的作用力,比化学键的键能小1~2个数量级,强度大小顺序为共价键⑭
② 氢键具有一定的方向性和饱和性,但本质上与共价键的方向性和饱和性不同。
a. 方向性:X—H…Y—三个原子一般在同一方向上。原因是在这样的方向上成键两原子电子云之间的排斥力最小,形成的氢键最强,体系最稳定。
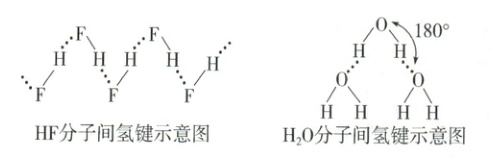
b. 饱和性:每一个X—H只能与一个Y原子形成氢键,原因是H原子半径很小,再有一个原子接近时,会受到X、Y原子电子云的排斥。
(4) 分类
氢键可分为⑯
(5) 对物质性质的影响
① 对物质熔、沸点的影响
a. 某些氢化物分子间存在氢键,如H₂O、NH₃、HF等,使其熔、沸点⑱
b. 同分异构体中形成分子间氢键的物质比形成分子内氢键的物质熔、沸点⑲ )⑳
)⑳ )。
)。
② 对物质溶解度的影响
溶剂和溶质之间形成氢键使溶质的溶解度㉑
③ 对物质密度的影响
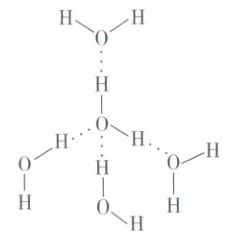
如下图所示,在冰中水分子间以氢键互相联结,形成相当疏松的晶体,从而在结构中有许多空隙,造成体积膨胀,密度减小。
(1) 概念:由已经与⑦
电负性
很大的原子形成共价键的氢原子(如水分子中的氢)与另一个⑧电负性
很大的原子(如水分子中的氧)之间的作用力。(2) 表示方法:氢键通常用X—H…Y—表示,其中X、Y为⑨
N
、⑩O
、⑪F
,“—”表示⑫共价键
,“…”表示形成的⑬氢键
。氢键键长一般定义为X—H…Y的长度,而不是H…Y的长度。(3) 特征
① 氢键不是化学键,而是一种较弱的作用力,比化学键的键能小1~2个数量级,强度大小顺序为共价键⑭
>
氢键⑮>
范德华力。② 氢键具有一定的方向性和饱和性,但本质上与共价键的方向性和饱和性不同。
a. 方向性:X—H…Y—三个原子一般在同一方向上。原因是在这样的方向上成键两原子电子云之间的排斥力最小,形成的氢键最强,体系最稳定。

b. 饱和性:每一个X—H只能与一个Y原子形成氢键,原因是H原子半径很小,再有一个原子接近时,会受到X、Y原子电子云的排斥。
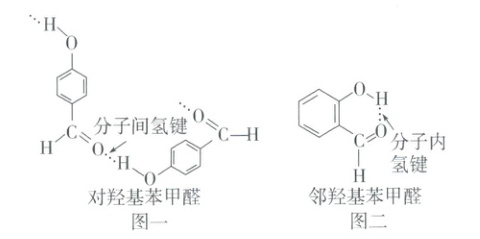
(4) 分类
氢键可分为⑯
分子间
氢键和⑰分子内
氢键两类,如对羟基苯甲醛分子间存在氢键(图一),邻羟基苯甲醛分子内存在氢键(图二)。
(5) 对物质性质的影响
① 对物质熔、沸点的影响
a. 某些氢化物分子间存在氢键,如H₂O、NH₃、HF等,使其熔、沸点⑱
高于
同族元素氢化物。b. 同分异构体中形成分子间氢键的物质比形成分子内氢键的物质熔、沸点⑲
高
,如熔、沸点:邻羟基苯甲酸( )⑳
)⑳<
对羟基苯甲酸( )。
)。② 对物质溶解度的影响
溶剂和溶质之间形成氢键使溶质的溶解度㉑
增大
,如氨、甲醇、甲醛、甲酸等㉒易
溶于水。③ 对物质密度的影响
如下图所示,在冰中水分子间以氢键互相联结,形成相当疏松的晶体,从而在结构中有许多空隙,造成体积膨胀,密度减小。

答案:
⑦电负性 ⑧电负性 ⑨N ⑩O ⑪F ⑫共价键 ⑬氢键 ⑭> ⑮> ⑯分子间 ⑰分子内 ⑱高于 ⑲高 ⑳< ㉑增大 ㉒易
查看更多完整答案,请扫码查看


