第107页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
- 第113页
- 第114页
- 第115页
- 第116页
- 第117页
- 第118页
- 第119页
- 第120页
- 第121页
- 第122页
- 第123页
- 第124页
- 第125页
- 第126页
- 第127页
- 第128页
- 第129页
- 第130页
- 第131页
- 第132页
- 第133页
- 第134页
- 第135页
1. 电解水时$H_2SO_4$只能增强水的导电性,不会参加化学反应。将溶质质量分数为20%的$H_2SO_4$溶液80g加入210g水,通电一段时间后产生氧气80g。
(相对原子质量:H—1,O—16)
求:(1)产生氢气的质量。
(2)反应后所得溶液中$H_2SO_4$的质量分数。
(相对原子质量:H—1,O—16)
求:(1)产生氢气的质量。
(2)反应后所得溶液中$H_2SO_4$的质量分数。
答案:
(1)10g
(2)8%
解:设产生$H_{2}$的质量为x。
$2H_{2}O \stackrel{通电}{=}2H_{2} \uparrow + O_{2} \uparrow$
4 32
x 80g
$\frac{x}{4} = \frac{80g}{32}$ x=10g
根据质量守恒定律,反应后$H_{2}SO_{4}$溶液的质量=80g+210g−80g−10g=200g
反应前$H_{2}SO_{4}$溶液中$H_{2}SO_{4}$的质量=80g×20%=16g
即反应后$H_{2}SO_{4}$溶液中$H_{2}SO_{4}$的质量=16g
由溶质的质量分数=$\frac{m_{质}}{m_{液}} × 100%$可知,反应后$H_{2}SO_{4}$溶液中$H_{2}SO_{4}$的质量分数=$\frac{16g}{200g} × 100%=8%$
答:反应后溶液中溶质的质量分数为8%。
(2)8%
解:设产生$H_{2}$的质量为x。
$2H_{2}O \stackrel{通电}{=}2H_{2} \uparrow + O_{2} \uparrow$
4 32
x 80g
$\frac{x}{4} = \frac{80g}{32}$ x=10g
根据质量守恒定律,反应后$H_{2}SO_{4}$溶液的质量=80g+210g−80g−10g=200g
反应前$H_{2}SO_{4}$溶液中$H_{2}SO_{4}$的质量=80g×20%=16g
即反应后$H_{2}SO_{4}$溶液中$H_{2}SO_{4}$的质量=16g
由溶质的质量分数=$\frac{m_{质}}{m_{液}} × 100%$可知,反应后$H_{2}SO_{4}$溶液中$H_{2}SO_{4}$的质量分数=$\frac{16g}{200g} × 100%=8%$
答:反应后溶液中溶质的质量分数为8%。
2. 实验室用过氧化氢溶液与二氧化锰混合制氧气。现将1.0g二氧化锰放入盛有20.0g过氧化氢溶液的锥形瓶中,立即塞紧带导管的橡胶塞,反应结束,共收集到559mL气体。请计算(结果保留一位小数):
(1)反应结束后,过滤,滤渣的质量为 ________g。
(2)反应产生氧气的质量为
(3)过氧化氢溶液中溶质的质量分数。
(1)反应结束后,过滤,滤渣的质量为 ________g。
(2)反应产生氧气的质量为
0.8
g。(标准状况下,氧气的密度约为1.43g/L)(3)过氧化氢溶液中溶质的质量分数。
答案:
(1)1.0
(2)0.8
(3)8.5%
解:设过氧化氢溶液中溶质的质量为x。
$2H_{2}O_{2} \stackrel{MnO_{2}}{=}2H_{2}O + O_{2} \uparrow$
68 32
x 0.8g
$\frac{x}{68} = \frac{0.8g}{32}$
x=1.7g
$\frac{1.7g}{20.0g} × 100%=8.5%$
答:过氧化氢溶液中溶质的质量分数为8.5%。
(2)0.8
(3)8.5%
解:设过氧化氢溶液中溶质的质量为x。
$2H_{2}O_{2} \stackrel{MnO_{2}}{=}2H_{2}O + O_{2} \uparrow$
68 32
x 0.8g
$\frac{x}{68} = \frac{0.8g}{32}$
x=1.7g
$\frac{1.7g}{20.0g} × 100%=8.5%$
答:过氧化氢溶液中溶质的质量分数为8.5%。
1. 为测定实验室中某过氧化氢溶液的溶质质量分数,小明取25.0g过氧化氢溶液放入烧杯中,然后进行如下图所示的实验。请计算:
(1)反应后产生气体的质量为
(2)此过氧化氢溶液的溶质质量分数。

(1)反应后产生气体的质量为
3.2
g。(2)此过氧化氢溶液的溶质质量分数。

答案:
(1)3.2
(2)27.2%
解:设过氧化氢的质量为x。
$2H_{2}O_{2} \stackrel{MnO_{2}}{=}2H_{2}O + O_{2} \uparrow$
68 32
x 3.2g
$\frac{68}{32} = \frac{x}{3.2g}$ x=6.8g
此过氧化氢溶液的溶质质量分数为$\frac{6.8g}{25.0g} × 100%=27.2%$
答:此过氧化氢溶液的溶质质量分数为27.2%。
(2)27.2%
解:设过氧化氢的质量为x。
$2H_{2}O_{2} \stackrel{MnO_{2}}{=}2H_{2}O + O_{2} \uparrow$
68 32
x 3.2g
$\frac{68}{32} = \frac{x}{3.2g}$ x=6.8g
此过氧化氢溶液的溶质质量分数为$\frac{6.8g}{25.0g} × 100%=27.2%$
答:此过氧化氢溶液的溶质质量分数为27.2%。
2. (南充中考)医用碳酸氢钠片可用于治疗胃酸过多,某同学为测定其中碳酸氢钠的质量分数,取10.0g样品放入烧杯中,分两次加入稀盐酸(该实验条件下杂质不参与反应),充分反应。测定实验数据如表所示。
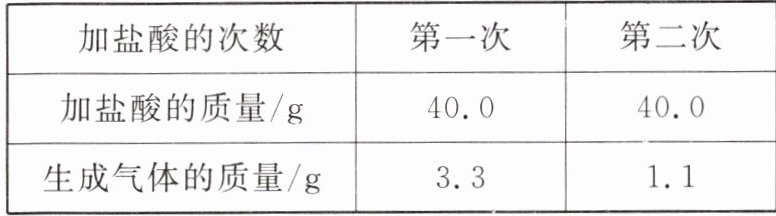
(1)两次加稀盐酸后,生成二氧化碳的总质量是
(2)该样品中碳酸氢钠的质量分数是多少?(写出计算过程)(反应的化学方程式为$NaHCO_3 + HCl = NaCl + H_2O + CO_2 \uparrow$)

(1)两次加稀盐酸后,生成二氧化碳的总质量是
4.4
g。(2)该样品中碳酸氢钠的质量分数是多少?(写出计算过程)(反应的化学方程式为$NaHCO_3 + HCl = NaCl + H_2O + CO_2 \uparrow$)
答案:
(1)4.4
(2)84%
解:设样品中碳酸氢钠的质量为x。
$NaHCO_{3} + HCl = NaCl + H_{2}O + CO_{2} \uparrow$
84 44
x 4.4g
$\frac{84}{44} = \frac{x}{4.4g}$
x=8.4g
样品中碳酸氢钠的质量分数为$\frac{8.4g}{10g} × 100%=84%$
答:样品中碳酸氢钠的质量分数为84%。
(2)84%
解:设样品中碳酸氢钠的质量为x。
$NaHCO_{3} + HCl = NaCl + H_{2}O + CO_{2} \uparrow$
84 44
x 4.4g
$\frac{84}{44} = \frac{x}{4.4g}$
x=8.4g
样品中碳酸氢钠的质量分数为$\frac{8.4g}{10g} × 100%=84%$
答:样品中碳酸氢钠的质量分数为84%。
3. (淄博中考)硅化镁($Mg_2Si$)在能源器件、激光和半导体制造等领域具有重要应用价值,可通过石英砂(主要成分为$SiO_2$,杂质不含硅元素)和金属镁反应制得,反应的化学方程式为$SiO_2 + 4Mg \stackrel{高温}{=} Mg_2Si + 2X$。
(1)上述化学方程式中$X$为
(2)用12.5kg石英砂与足量镁充分反应得到15.2kg硅化镁,计算石英砂中$SiO_2$的质量分数。(写出计算过程)
(1)上述化学方程式中$X$为
$MgO$
(填化学式)。(2)用12.5kg石英砂与足量镁充分反应得到15.2kg硅化镁,计算石英砂中$SiO_2$的质量分数。(写出计算过程)
答案:
(1)$MgO$
(2)96%
解:设石英砂中$SiO_{2}$的质量分数为x。
$SiO_{2} + 4Mg \stackrel{高温}{=} Mg_{2}Si + 2MgO$
60 76
12.5kg×x 15.2kg
$\frac{60}{76} = \frac{12.5kg × x}{15.2kg}$
x=96%
答:石英砂中$SiO_{2}$的质量分数为96%。
(2)96%
解:设石英砂中$SiO_{2}$的质量分数为x。
$SiO_{2} + 4Mg \stackrel{高温}{=} Mg_{2}Si + 2MgO$
60 76
12.5kg×x 15.2kg
$\frac{60}{76} = \frac{12.5kg × x}{15.2kg}$
x=96%
答:石英砂中$SiO_{2}$的质量分数为96%。
查看更多完整答案,请扫码查看


