第9页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
10. 「★☆」食用碱的主要成分是$Na_2CO_3$(含有少量$NaCl$),研究小组为测定市售食用碱中$Na_2CO_3$的含量,设计了如图所示实验装置。
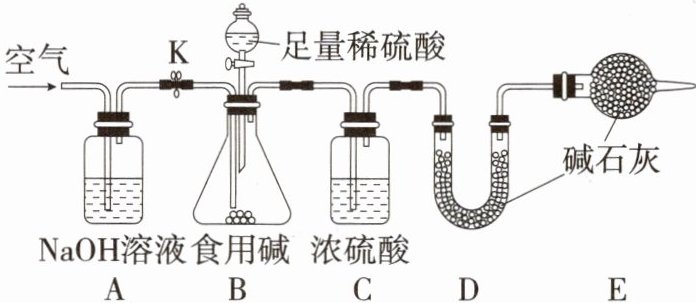
取12克食用碱样品放入锥形瓶进行实验。按定量测定实验的正确步骤,进行规范操作,并用电子天平对某一装置进行连续称重,此时该装置质量增加了4.4克(假设每步吸收都完全,ACDE装置中试剂均过量)。回答下列问题。
(1) 装置A的作用是____
(2) 根据某装置质量不再改变时,作为停止实验的依据,则该装置应该是____
(3) 计算食用碱中$Na_2CO_3$的质量分数。(要求根据化学方程式计算)
解:设食用碱中$Na_2CO_3$的质量分数是$x$。
$Na_2CO_3 + H_2SO_4 = Na_2SO_4 + H_2O + CO_2 \uparrow$
106 44
$12g × x$ 4.4g
$\frac{106}{44} = \frac{12g × x}{4.4g}$ $x \approx 88.3\%$
答:食用碱中$Na_2CO_3$的质量分数约为$88.3\%$。

取12克食用碱样品放入锥形瓶进行实验。按定量测定实验的正确步骤,进行规范操作,并用电子天平对某一装置进行连续称重,此时该装置质量增加了4.4克(假设每步吸收都完全,ACDE装置中试剂均过量)。回答下列问题。
(1) 装置A的作用是____
吸收空气中的二氧化碳
。(2) 根据某装置质量不再改变时,作为停止实验的依据,则该装置应该是____
D
(填字母)。(3) 计算食用碱中$Na_2CO_3$的质量分数。(要求根据化学方程式计算)
解:设食用碱中$Na_2CO_3$的质量分数是$x$。
$Na_2CO_3 + H_2SO_4 = Na_2SO_4 + H_2O + CO_2 \uparrow$
106 44
$12g × x$ 4.4g
$\frac{106}{44} = \frac{12g × x}{4.4g}$ $x \approx 88.3\%$
答:食用碱中$Na_2CO_3$的质量分数约为$88.3\%$。
答案:
答案 (1)吸收空气中的二氧化碳 (2)D (3)解:设食用碱中$Na_2CO_3$的质量分数是$x$。
$Na_2CO_3 + H_2SO_4 = Na_2SO_4 + H_2O + CO_2 \uparrow$
106 44
$12g \times x$ 4.4g
$\frac{106}{44} = \frac{12g \times x}{4.4g}$ $x \approx 88.3\%$
答:食用碱中$Na_2CO_3$的质量分数约为$88.3\%$。
解析 (1)氢氧化钠溶液能吸收空气中的二氧化碳气体,防止对实验产生干扰。(2)C装置的作用是吸收水蒸气,D装置的作用是吸收生成的二氧化碳,E装置的作用是防止空气中的二氧化碳和水蒸气进入D装置。故应将D装置的质量不再改变作为停止实验的依据。
$Na_2CO_3 + H_2SO_4 = Na_2SO_4 + H_2O + CO_2 \uparrow$
106 44
$12g \times x$ 4.4g
$\frac{106}{44} = \frac{12g \times x}{4.4g}$ $x \approx 88.3\%$
答:食用碱中$Na_2CO_3$的质量分数约为$88.3\%$。
解析 (1)氢氧化钠溶液能吸收空气中的二氧化碳气体,防止对实验产生干扰。(2)C装置的作用是吸收水蒸气,D装置的作用是吸收生成的二氧化碳,E装置的作用是防止空气中的二氧化碳和水蒸气进入D装置。故应将D装置的质量不再改变作为停止实验的依据。
11. 牙膏常用碳酸钙、二氧化硅等物质作为摩擦剂,某同学对摩擦剂中碳酸钙的含量进行探究。
【实验原理】
测定如图C装置中生成的$BaCO_3$沉淀的质量,通过计算确定牙膏中$CaCO_3$的质量分数。
【查阅资料】
$CO_2 + Ba(OH)_2 = BaCO_3 \downarrow + H_2O$,牙膏中其他成分遇到盐酸时无气体产生。
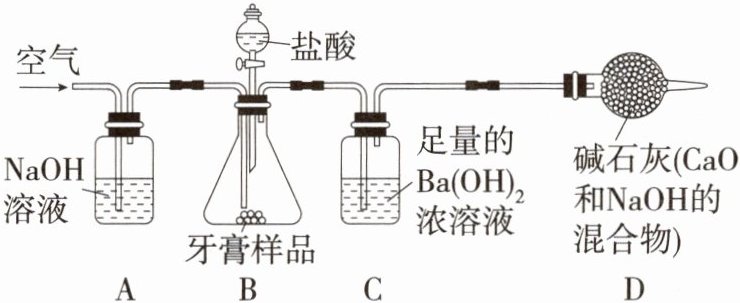
根据探究过程回答下列问题:
(1) 从C中过滤出$BaCO_3$沉淀所需的玻璃仪器有烧杯、玻璃棒和
(2) 实验过程中先后两次鼓入空气,其中第二次鼓入空气的目的是
(3) 实验中准确称取4g样品三份,进行三次测定,测得$BaCO_3$平均质量为1.97g,则样品中碳酸钙的质量分数为
【实验原理】
测定如图C装置中生成的$BaCO_3$沉淀的质量,通过计算确定牙膏中$CaCO_3$的质量分数。
【查阅资料】
$CO_2 + Ba(OH)_2 = BaCO_3 \downarrow + H_2O$,牙膏中其他成分遇到盐酸时无气体产生。

根据探究过程回答下列问题:
(1) 从C中过滤出$BaCO_3$沉淀所需的玻璃仪器有烧杯、玻璃棒和
漏斗
。(2) 实验过程中先后两次鼓入空气,其中第二次鼓入空气的目的是
使反应生成的二氧化碳全部被氢氧化钡溶液吸收
。(3) 实验中准确称取4g样品三份,进行三次测定,测得$BaCO_3$平均质量为1.97g,则样品中碳酸钙的质量分数为
25%
。
答案:
答案 (1)漏斗 (2)使反应生成的二氧化碳全部被氢氧化钡溶液吸收 (3)$25\%$
解析 (3)设样品中碳酸钙的质量分数为$x$。根据碳酸钙、二氧化碳和碳酸钡的质量关系得:
$CaCO_3 \sim CO_2 \sim BaCO_3$
100 197
$4g \times x$ 1.97g
$\frac{100}{197} = \frac{4g \times x}{1.97g}$
$x = 25\%$。
解析 (3)设样品中碳酸钙的质量分数为$x$。根据碳酸钙、二氧化碳和碳酸钡的质量关系得:
$CaCO_3 \sim CO_2 \sim BaCO_3$
100 197
$4g \times x$ 1.97g
$\frac{100}{197} = \frac{4g \times x}{1.97g}$
$x = 25\%$。
查看更多完整答案,请扫码查看


