第21页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
7.「2024杭州公益中学月考,★☆」海水通过晒制得到的粗盐中常含有泥沙、$MgCl_{2}$、$CaCl_{2}$、$Na_{2}SO_{4}$等杂质,如图是除去粗盐中可溶性杂质的过程,下列说法正确的是 (
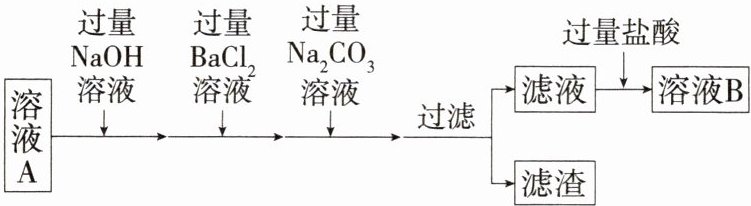
A.$BaCl_{2}和Na_{2}CO_{3}$的添加顺序不能颠倒,否则除不尽$Ba^{2+}$
B.滤渣中共有三种沉淀
C.为证明所加盐酸过量,可取少量溶液B,向其中滴加硝酸银溶液,看是否有沉淀生成
D.经过一系列除杂操作后,最终得到溶液B中的溶质只有NaCl
A
)
A.$BaCl_{2}和Na_{2}CO_{3}$的添加顺序不能颠倒,否则除不尽$Ba^{2+}$
B.滤渣中共有三种沉淀
C.为证明所加盐酸过量,可取少量溶液B,向其中滴加硝酸银溶液,看是否有沉淀生成
D.经过一系列除杂操作后,最终得到溶液B中的溶质只有NaCl
答案:
A 添加碳酸钠溶液要放在添加氯化钡溶液之后,这样可以将过量的钡离子沉淀,A正确;滤渣中共有氢氧化镁、硫酸钡、碳酸钡、碳酸钙四种沉淀,B错误;氯化钠也能与硝酸银溶液反应生成氯化银沉淀,C错误;经过一系列除杂操作后,最终得到溶液B中的溶质有${NaCl}$、${HCl}$,D错误。
8.新中考框图推断「★☆」氧化物、酸、碱、盐相互之间的关系是初中科学中重要学习内容之一。现有如图转换关系:
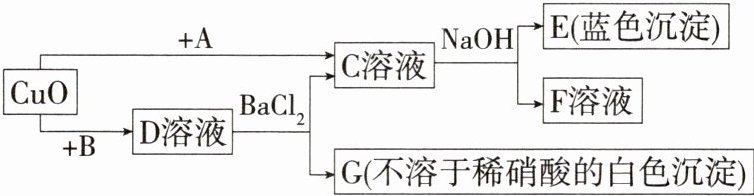
(1)请写出B物质的化学式:
(2)请写出C溶液与NaOH反应的化学方程式:

(1)请写出B物质的化学式:
${H_{2}SO_{4}}$
;(2)请写出C溶液与NaOH反应的化学方程式:
${2NaOH + CuCl_{2}=Cu(OH)_{2}↓ + 2NaCl}$
。
答案:
答案 (1)${H_{2}SO_{4}}$ (2)${2NaOH + CuCl_{2}=Cu(OH)_{2}↓ + 2NaCl}$
解析 根据框图中物质转化关系分析可知,不溶于稀硝酸的沉淀G为硫酸钡,C溶液和氢氧化钠反应会生成蓝色沉淀E和F溶液,所以E为氢氧化铜,C溶液中含有铜离子,由复分解反应的原理可知,D溶液中含有铜离子,D为硫酸铜,B为硫酸,C为氯化铜,F为氯化钠,A为盐酸,经过验证,推导正确。
解析 根据框图中物质转化关系分析可知,不溶于稀硝酸的沉淀G为硫酸钡,C溶液和氢氧化钠反应会生成蓝色沉淀E和F溶液,所以E为氢氧化铜,C溶液中含有铜离子,由复分解反应的原理可知,D溶液中含有铜离子,D为硫酸铜,B为硫酸,C为氯化铜,F为氯化钠,A为盐酸,经过验证,推导正确。
9.「2023丽水中考,★☆」小科学习了物质的性质后,梳理单质、氧化物、酸、碱、盐与X之间的转化关系如图所示。“→”表示某一种物质经一步反应可转化为另一种物质,部分反应物、生成物及反应条件已略去。
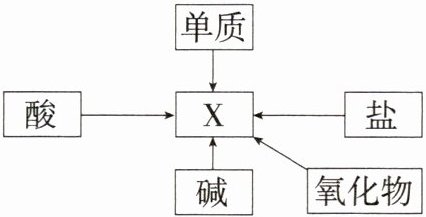
(1)若X是氯化钠,它在物质分类上属于化合物中的
(2)若X是水,则能实现图中物质转化的基本反应类型有(
A.化合反应
B.分解反应
C.置换反应
D.复分解反应

(1)若X是氯化钠,它在物质分类上属于化合物中的
盐
,图中碱的化学式为NaOH
。(2)若X是水,则能实现图中物质转化的基本反应类型有(
ABCD
)(填字母)。A.化合反应
B.分解反应
C.置换反应
D.复分解反应
答案:
答案 (1)盐 ${NaOH}$ (2)${ABCD}$
解析 (1)氯化钠是由钠离子和氯离子构成的化合物,属于盐;氢氧化钠可以和盐酸反应生成氯化钠,图中碱应为氢氧化钠,其化学式为${NaOH}$。(2)若X是水,氢气在氧气中燃烧生成水,属于化合反应;氢气和氧化铜在加热条件下生成铜和水,属于置换反应;酸和碱反应生成盐和水,属于复分解反应;碳酸分解生成水和二氧化碳,属于分解反应。
解析 (1)氯化钠是由钠离子和氯离子构成的化合物,属于盐;氢氧化钠可以和盐酸反应生成氯化钠,图中碱应为氢氧化钠,其化学式为${NaOH}$。(2)若X是水,氢气在氧气中燃烧生成水,属于化合反应;氢气和氧化铜在加热条件下生成铜和水,属于置换反应;酸和碱反应生成盐和水,属于复分解反应;碳酸分解生成水和二氧化碳,属于分解反应。
10.「2024江苏南通中考」实验室以一种工业废渣(主要成分为$MgCO_{3}$,含少量$FeO$、$Fe_{2}O_{3}$、$Al_{2}O_{3}$)为原料制备$MgCO_{3}$。实验过程如下:
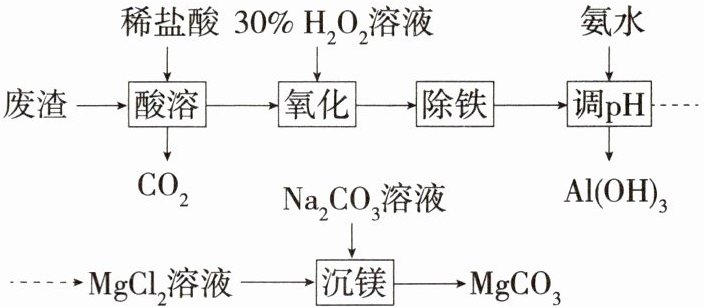
已知:①在溶液中,$pH= 5.0时AlCl_{3}完全转化为Al(OH)_{3}$沉淀,$pH= 8.5时MgCl_{2}开始生成Mg(OH)_{2}$沉淀。
②$MgCl_{2}在过量Na_{2}CO_{3}溶液中会生成Mg(OH)_{2}$沉淀。
(1)“酸溶”时,$MgCO_{3}$与稀盐酸反应的化学方程式为____
(2)“氧化”时发生的反应为$2FeCl_{2}+2HCl+H_{2}O_{2}= 2FeCl_{3}+2H_{2}O$。
①反应前后化合价发生变化的元素有O、____
②“酸溶”时需加入稍过量的稀盐酸,原因可能是____
(3)“调pH”时,需控制溶液pH为____
(4)“沉镁”时,为提高$MgCO_{3}$的纯度,试剂加入顺序为____

已知:①在溶液中,$pH= 5.0时AlCl_{3}完全转化为Al(OH)_{3}$沉淀,$pH= 8.5时MgCl_{2}开始生成Mg(OH)_{2}$沉淀。
②$MgCl_{2}在过量Na_{2}CO_{3}溶液中会生成Mg(OH)_{2}$沉淀。
(1)“酸溶”时,$MgCO_{3}$与稀盐酸反应的化学方程式为____
${MgCO_{3} + 2HCl=MgCl_{2} + CO_{2}↑ + H_{2}O}$
。(2)“氧化”时发生的反应为$2FeCl_{2}+2HCl+H_{2}O_{2}= 2FeCl_{3}+2H_{2}O$。
①反应前后化合价发生变化的元素有O、____
${Fe}$
。②“酸溶”时需加入稍过量的稀盐酸,原因可能是____
使废渣溶解充分,提高原料的浸出率(合理即可)
(写一条)。(3)“调pH”时,需控制溶液pH为____
${5.0≤pH<8.5}$
。(4)“沉镁”时,为提高$MgCO_{3}$的纯度,试剂加入顺序为____
b
(填“a”或“b”)。
答案:
答案 (1)${MgCO_{3} + 2HCl=MgCl_{2} + CO_{2}↑ + H_{2}O}$ (2)①${Fe}$ ②使废渣溶解充分,提高原料的浸出率(合理即可) (3)${5.0≤pH<8.5}$ (4)b
解析 (2)①亚铁离子被氧化为铁离子,铁元素化合价升高;氧元素由-1价变为-2价,化合价降低,因此反应前后化合价发生变化的元素有${O}$、${Fe}$。(3)根据已知信息分析,“调${pH}$”时,需保证${AlCl_{3}}$完全转化为${Al(OH)_{3}}$沉淀,则${pH≥5.0}$,且要保证${MgCl_{2}}$不能转化成${Mg(OH)_{2}}$沉淀,则${pH<8.5}$,故溶液${pH}$为${5.0≤pH<8.5}$。
解析 (2)①亚铁离子被氧化为铁离子,铁元素化合价升高;氧元素由-1价变为-2价,化合价降低,因此反应前后化合价发生变化的元素有${O}$、${Fe}$。(3)根据已知信息分析,“调${pH}$”时,需保证${AlCl_{3}}$完全转化为${Al(OH)_{3}}$沉淀,则${pH≥5.0}$,且要保证${MgCl_{2}}$不能转化成${Mg(OH)_{2}}$沉淀,则${pH<8.5}$,故溶液${pH}$为${5.0≤pH<8.5}$。
查看更多完整答案,请扫码查看


