第22页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
1.「2025杭州绿城育华学校期中」将某氢氧化钠溶液逐滴滴入硫酸和硫酸铜的混合溶液中,直至过量。根据实验事实绘制如图所示曲线。其中说法正确的是(
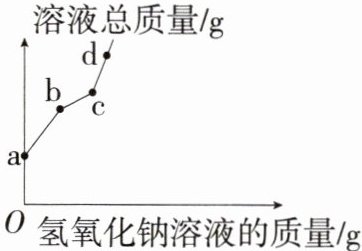
A.a至b段有蓝色沉淀生成
B.a至d段硫酸钠质量不断增大
C.c至d段,溶液pH不断减小
D.c点比a点所含的溶质种类少
D
)
A.a至b段有蓝色沉淀生成
B.a至d段硫酸钠质量不断增大
C.c至d段,溶液pH不断减小
D.c点比a点所含的溶质种类少
答案:
1.D 向硫酸和硫酸铜的混合溶液中滴加氢氧化钠溶液,氢氧化钠先和硫酸反应,后和硫酸铜反应。a至b段代表氢氧化钠与硫酸反应的过程,b至c段代表氢氧化钠与硫酸铜反应的过程,c至d段代表氢氧化钠过量。a至b段是氢氧化钠中和硫酸,没有蓝色沉淀生成,A错误;a至b段、b至c段都有硫酸钠生成,其质量逐渐增大,c至d段没有硫酸钠生成,其质量不变,B错误;c至d段,氢氧化钠过量,溶液中氢氧化钠增多,pH增大,C错误;a点时溶液中的溶质为硫酸和硫酸铜,c点时硫酸铜恰好完全反应,此时对应溶液中的溶质只有硫酸钠,溶质种类最少,D正确。
2.「2024杭州十五中期中」向一定质量的$Na_2CO_3$溶液中滴加一定质量的$Ba(OH)_2$溶液,反应一段时间后改为滴加$Ca(OH)_2$溶液,当恰好不再产生沉淀时,再滴加稀盐酸至沉淀消失。反应过程中产生沉淀的质量与加入物质的质量关系如图所示。下列说法错误的是(
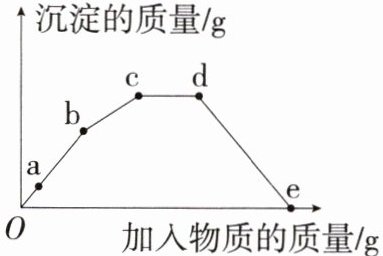
A.a点溶液中溶质有NaOH和$Na_2CO_3$
B.c至d段发生反应的化学方程式为$NaOH+HCl= NaCl+H_2O$
C.整个过程溶液中的溶质种类最多含有2种
D.d至e段有气泡产生
C
)
A.a点溶液中溶质有NaOH和$Na_2CO_3$
B.c至d段发生反应的化学方程式为$NaOH+HCl= NaCl+H_2O$
C.整个过程溶液中的溶质种类最多含有2种
D.d至e段有气泡产生
答案:
2.C 碳酸钠和氢氧化钡反应生成碳酸钡沉淀和氢氧化钠,a点溶液中碳酸钠有剩余,溶质为$Na_2CO_3$、NaOH,A正确;c至d段,沉淀的质量不变,发生的反应是稀盐酸与氢氧化钠反应生成氯化钠和水,B正确;d至e段,溶液中的溶质种类最多,含有氯化钠、氯化钡、氯化钙3种,C错误;d至e段,稀盐酸和碳酸钡、碳酸钙反应均会生成二氧化碳气体,有气泡产生,D正确。
3.「2025湖州长兴月考」向盐酸和氯化钙的混合溶液中逐滴滴入碳酸钠溶液,并用pH传感器连续监测,得到pH随时间的变化曲线如图所示。(注:碳酸钠溶液显碱性)
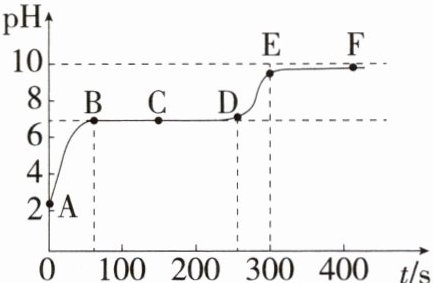
(1)向原混合溶液中滴入少量紫色石蕊试液,则AB段溶液颜色变化为______
(2)图中C点溶液所含的溶质为______
(3)图中DE段pH上升的原因是______

(1)向原混合溶液中滴入少量紫色石蕊试液,则AB段溶液颜色变化为______
由红色变为紫色
;(2)图中C点溶液所含的溶质为______
氯化钠、氯化钙
;(3)图中DE段pH上升的原因是______
加入的碳酸钠溶液呈碱性,使溶液的碱性增强
。
答案:
3.答案
(1)由红色变为紫色
(2)氯化钠、氯化钙
(3)加入的碳酸钠溶液呈碱性,使溶液的碱性增强
解析 向盐酸和氯化钙的混合溶液中逐滴滴入碳酸钠溶液,碳酸钠先与盐酸反应生成氯化钠、水和二氧化碳气体,溶液的酸性逐渐减弱,pH逐渐增大,稀盐酸刚好消耗完时,溶液显中性,pH = 7;碳酸钠再与氯化钙反应生成碳酸钙白色沉淀和氯化钠,这一过程中pH = 7;等氯化钙完全反应后,继续滴加碳酸钠溶液,溶液显碱性,pH大于7。
(1)向原混合溶液中滴入少量紫色石蕊试液,AB段溶液颜色变化是由红色变为紫色。
(2)C点pH = 7,发生的反应是碳酸钠与氯化钙反应生成碳酸钙白色沉淀和氯化钠,C点时氯化钙有剩余,则溶液所含的溶质为氯化钠、氯化钙。
(3)DE段是氯化钙完全反应后继续加入碳酸钠溶液,加入的碳酸钠溶液呈碱性,使溶液的碱性增强,pH上升。
(1)由红色变为紫色
(2)氯化钠、氯化钙
(3)加入的碳酸钠溶液呈碱性,使溶液的碱性增强
解析 向盐酸和氯化钙的混合溶液中逐滴滴入碳酸钠溶液,碳酸钠先与盐酸反应生成氯化钠、水和二氧化碳气体,溶液的酸性逐渐减弱,pH逐渐增大,稀盐酸刚好消耗完时,溶液显中性,pH = 7;碳酸钠再与氯化钙反应生成碳酸钙白色沉淀和氯化钠,这一过程中pH = 7;等氯化钙完全反应后,继续滴加碳酸钠溶液,溶液显碱性,pH大于7。
(1)向原混合溶液中滴入少量紫色石蕊试液,AB段溶液颜色变化是由红色变为紫色。
(2)C点pH = 7,发生的反应是碳酸钠与氯化钙反应生成碳酸钙白色沉淀和氯化钠,C点时氯化钙有剩余,则溶液所含的溶质为氯化钠、氯化钙。
(3)DE段是氯化钙完全反应后继续加入碳酸钠溶液,加入的碳酸钠溶液呈碱性,使溶液的碱性增强,pH上升。
4.「2024杭州弘益中学月考」烧杯中盛有$MgCl_2$和HCl的混合溶液100g,向其中滴加溶质质量分数为10%的NaOH溶液,烧杯中溶液的质量与滴加NaOH溶液的质量关系如图所示。
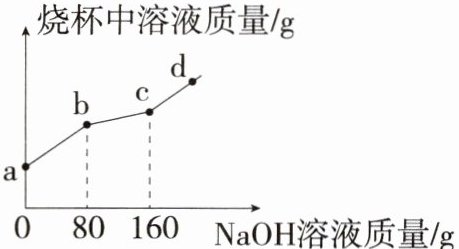
(1)图中ab段所对应反应的化学方程式为
(2)图中d点对应溶液中的溶质是
(3)计算图中bc段溶液增加的质量为多少克?
解:bc段为氢氧化钠与氯化镁反应的过程,溶液增加的质量等于加入的溶液质量与生成沉淀质量之差。设生成氢氧化镁沉淀的质量为x。
$2NaOH + MgCl_2══Mg(OH)_2↓ + 2NaCl$
80 58
$(160g - 80g)×10\%$ x
$\frac{80}{58}=\frac{(160g - 80g)×10\%}{x}$ x = 5.8g
bc段溶液增加的质量为80g - 5.8g = 74.2g。
答:bc段溶液增加的质量为

(1)图中ab段所对应反应的化学方程式为
$NaOH + HCl══NaCl + H_2O$
。(2)图中d点对应溶液中的溶质是
NaCl、NaOH
。(3)计算图中bc段溶液增加的质量为多少克?
解:bc段为氢氧化钠与氯化镁反应的过程,溶液增加的质量等于加入的溶液质量与生成沉淀质量之差。设生成氢氧化镁沉淀的质量为x。
$2NaOH + MgCl_2══Mg(OH)_2↓ + 2NaCl$
80 58
$(160g - 80g)×10\%$ x
$\frac{80}{58}=\frac{(160g - 80g)×10\%}{x}$ x = 5.8g
bc段溶液增加的质量为80g - 5.8g = 74.2g。
答:bc段溶液增加的质量为
74.2
克。
答案:
4.答案
(1)$NaOH + HCl══NaCl + H_2O$
(2)NaCl、NaOH
(3)解:bc段为氢氧化钠与氯化镁反应的过程,溶液增加的质量等于加入的溶液质量与生成沉淀质量之差。设生成氢氧化镁沉淀的质量为x。
$2NaOH + MgCl_2══Mg(OH)_2↓ + 2NaCl$
80 58
$(160g - 80g)×10\%$ x
$\frac{80}{58}=\frac{(160g - 80g)×10\%}{x}$ x = 5.8g
bc段溶液增加的质量为80g - 5.8g = 74.2g。
答:bc段溶液增加的质量为74.2g。
解析
(2)向$MgCl_2$和HCl的混合溶液中滴加NaOH溶液,氢氧化钠先与盐酸反应,后与氯化镁反应,故ab段代表氢氧化钠与盐酸反应的过程,bc段代表氢氧化钠与氯化镁反应的过程,c点之后代表氢氧化钠过量。滴加至c点时溶液中的溶质只有氯化钠,d点时氢氧化钠过量,故d点对应溶液中的溶质为NaCl、NaOH。
(1)$NaOH + HCl══NaCl + H_2O$
(2)NaCl、NaOH
(3)解:bc段为氢氧化钠与氯化镁反应的过程,溶液增加的质量等于加入的溶液质量与生成沉淀质量之差。设生成氢氧化镁沉淀的质量为x。
$2NaOH + MgCl_2══Mg(OH)_2↓ + 2NaCl$
80 58
$(160g - 80g)×10\%$ x
$\frac{80}{58}=\frac{(160g - 80g)×10\%}{x}$ x = 5.8g
bc段溶液增加的质量为80g - 5.8g = 74.2g。
答:bc段溶液增加的质量为74.2g。
解析
(2)向$MgCl_2$和HCl的混合溶液中滴加NaOH溶液,氢氧化钠先与盐酸反应,后与氯化镁反应,故ab段代表氢氧化钠与盐酸反应的过程,bc段代表氢氧化钠与氯化镁反应的过程,c点之后代表氢氧化钠过量。滴加至c点时溶液中的溶质只有氯化钠,d点时氢氧化钠过量,故d点对应溶液中的溶质为NaCl、NaOH。
查看更多完整答案,请扫码查看


