第25页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
6.「2024台州玉环三模」化学变化往往会导致一些量发生改变。现向盛有一定量$Na_2CO_3$溶液的容器中不断滴入$Ca(OH)_2$溶液至过量,下列图像能正确反映容器中相关量随时间变化的是 (
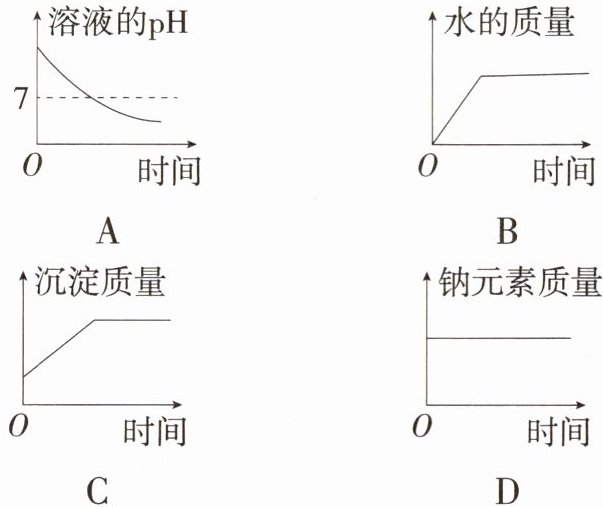
D
)
答案:
D 碳酸钠、氢氧化钙及氢氧化钠溶液均呈碱性,溶液的 pH 不会小于 7,A 错误;碳酸钠溶液中本身就含有水,水的质量不可能从零开始逐渐增大,B 错误;沉淀质量应该从零开始逐渐增大,然后不变,C 错误;氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠,钠元素的质量始终不变,D 正确。
7.「2024杭州西湖联考」向盛有$50 g 10% Ba(OH)_2$溶液的烧杯中慢慢滴加稀硫酸至过量,下图中有关量的变化与所加入稀硫酸质量的关系错误的是 (
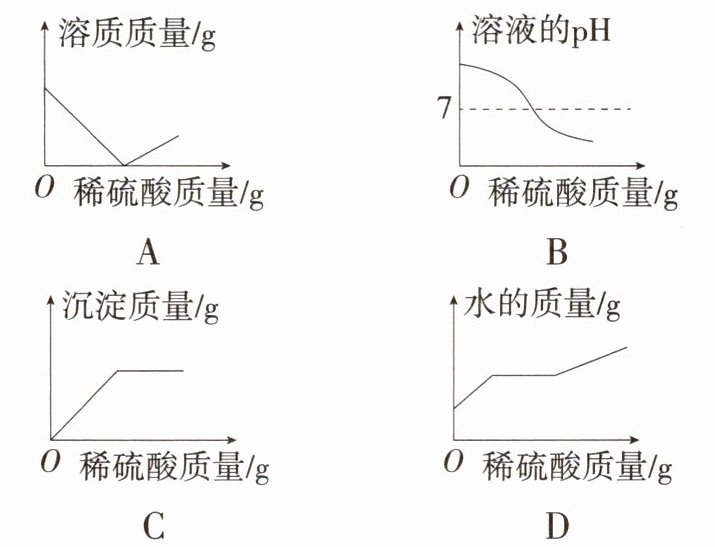
D
)
答案:
D 稀硫酸和氢氧化钡反应生成硫酸钡沉淀和水,当两者不断反应至氢氧化钡恰好完全反应时,溶质的质量逐渐减小至 0,当稀硫酸过量时溶质的质量又逐渐增大,A 不符合题意;氢氧化钡溶液显碱性,随着稀硫酸质量的增加,pH 由大于 7 逐渐变小,直至氢氧化钡恰好完全反应时 $ pH = 7 $,继续加入稀硫酸,溶液酸性不断增强,pH 小于 7,B 不符合题意;随着反应的进行,沉淀的质量从零开始不断增大,直至氢氧化钡恰好完全反应,沉淀的质量不再改变,C 不符合题意;慢慢滴加稀硫酸至过量,水的质量不断增加,不会出现不变的情况,D 符合题意。
8.「2024杭州西湖联考」向一定质量的$Na_2CO_3$和$Na_2SO_4$混合溶液中先后滴加$BaCl_2$溶液、盐酸,反应过程中加入溶液的质量与产生沉淀或气体的质量关系如图所示。下列说法正确的是 (
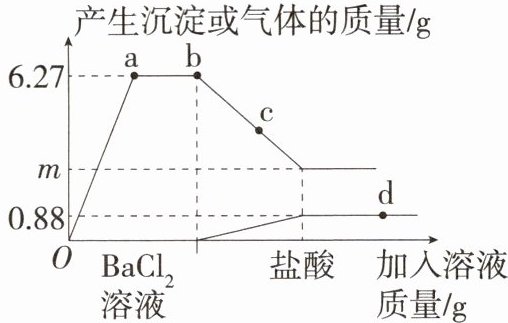
A.0至a段发生了一个反应
B.c点沉淀的成分为一种
C.m= 2.33
D.取d点对应的溶液,滴加硝酸银溶液,有白色沉淀,说明加入的盐酸已过量
C
)
A.0至a段发生了一个反应
B.c点沉淀的成分为一种
C.m= 2.33
D.取d点对应的溶液,滴加硝酸银溶液,有白色沉淀,说明加入的盐酸已过量
答案:
C 0 至 a 段发生的反应是碳酸钠和氯化钡反应生成碳酸钡沉淀和氯化钠,硫酸钠和氯化钡反应生成硫酸钡沉淀和氯化钠,A 错误;因硫酸钡沉淀不溶于酸,碳酸钡沉淀能与酸反应,c 点时,沉淀质量没有减少到最小,所以此时沉淀是碳酸钡和硫酸钡的混合物,B 错误;设反应生成的碳酸钡沉淀的质量为 $ x $,
$\begin{aligned}BaCO_3 &\sim CO_2\\197 &\quad 44\\x &\quad 0.88g\end{aligned}$
$\frac{197}{44} = \frac{x}{0.88g} \quad x = 3.94g$
所以 $ m = 6.27 - 3.94 = 2.33 $,C 正确;d 点溶液中一定有 $ NaCl $ 和 $ BaCl_2 $,故取 d 点对应的溶液,滴加硝酸银溶液,一定有白色沉淀出现,故并不能说明盐酸过量,D 错误。
$\begin{aligned}BaCO_3 &\sim CO_2\\197 &\quad 44\\x &\quad 0.88g\end{aligned}$
$\frac{197}{44} = \frac{x}{0.88g} \quad x = 3.94g$
所以 $ m = 6.27 - 3.94 = 2.33 $,C 正确;d 点溶液中一定有 $ NaCl $ 和 $ BaCl_2 $,故取 d 点对应的溶液,滴加硝酸银溶液,一定有白色沉淀出现,故并不能说明盐酸过量,D 错误。
9.「2025温州瑞安五校联考期中」现有盐酸和$BaCl_2$的混合溶液,向其中逐滴加入过量的某物质X,溶液的pH变化如图所示。则X可能是 (
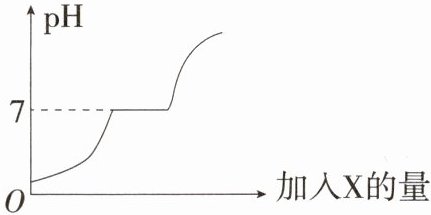
A.稀硫酸
B.纯碱溶液
C.食盐溶液
D.氢氧化钠溶液
B
)
A.稀硫酸
B.纯碱溶液
C.食盐溶液
D.氢氧化钠溶液
答案:
B 加入稀硫酸时,溶液中氢离子增多且不参加反应,溶液的 pH 不会等于乃至大于 7,A 不符合题意。加入纯碱溶液时,碳酸钠先和盐酸反应,随着反应的进行,溶液的酸性减弱,pH 升高,当盐酸恰好完全反应时溶液显中性;继续加入纯碱溶液,碳酸钠再和氯化钡反应生成碳酸钡沉淀和氯化钠,在碳酸钠和氯化钡反应的过程中溶液的 pH 不变;当氯化钡完全反应后,再加入纯碱溶液,溶液的 pH 升高,B 符合题意;加入食盐溶液时,食盐溶液显中性,溶液被稀释,溶液的酸性减弱,pH 增大,但不可能大于或等于 7,C 不符合题意;加入氢氧化钠溶液时,氢氧化钠会与盐酸反应,溶液 pH 增大,氢氧化钠不会与氯化钡反应,曲线不会有水平一段,D 不符合题意。
10.「2025杭州采荷中学月考」实验室有一个烧杯中含有HCl和$CuCl_2$的混合液,现将一定溶质质量分数的氢氧化钠溶液滴入混合液中直至过量(忽略$CuCl_2$溶液的弱酸性,即$CuCl_2$溶液看成呈中性),则反应中各个量的图像正确的是 (
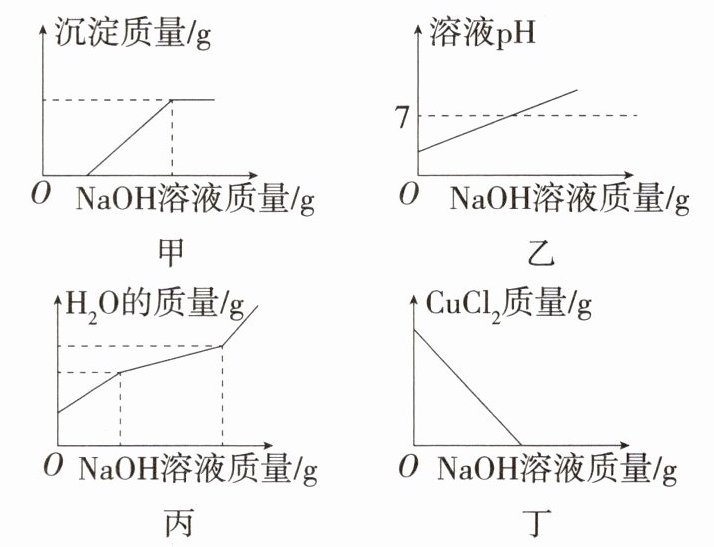
A.甲、乙、丁
B.乙、丙、丁
C.甲、丙
D.甲
D
)
A.甲、乙、丁
B.乙、丙、丁
C.甲、丙
D.甲
答案:
D 氢氧化钠先和盐酸反应生成氯化钠和水,再和氯化铜反应生成氢氧化铜蓝色沉淀和氯化钠,甲曲线正确;盐酸显酸性,氢氧化钠和盐酸反应生成的氯化钠的溶液呈中性,所以一开始溶液 pH 由小于 7 逐渐变大至等于 7,在氢氧化钠和氯化铜的反应过程中,中间有一段 $ pH = 7 $ 不变的过程,最后氢氧化钠溶液过量,溶液呈碱性,pH 大于 7,乙曲线错误;氢氧化钠和盐酸反应生成水,氢氧化钠溶液中也有水,所以起始时水的来源有两部分,氢氧化钠和氯化铜反应没有水生成,只有氢氧化钠溶液中的水,水的来源只有一部分,最后氢氧化钠溶液过量,水的来源同样只有氢氧化钠溶液中的水,所以曲线中只有 1 个拐点,丙曲线错误;氢氧化钠先和盐酸反应,所以起始时溶液中氯化铜质量不变,氯化铜和氢氧化钠反应时,氯化铜质量减小直至为零,丁曲线错误。
查看更多完整答案,请扫码查看


