第15页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
7. 新中考 数字化实验「2024四川攀枝花仁和一模,★☆」运用手持技术探究金属与酸的反应。向 250 mL 的烧瓶内注入 25 mL 一定浓度的稀盐酸,分别剪取长 4 cm、宽 0.4 cm 的镁条、铝条、锌条、铁条、铜条,打磨后投入烧瓶中,迅速塞紧带有压强传感器的橡皮塞(见图 1),采集数据得到如图 2 所示的压强变化曲线。回答下列问题:
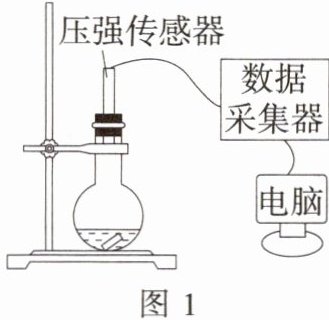
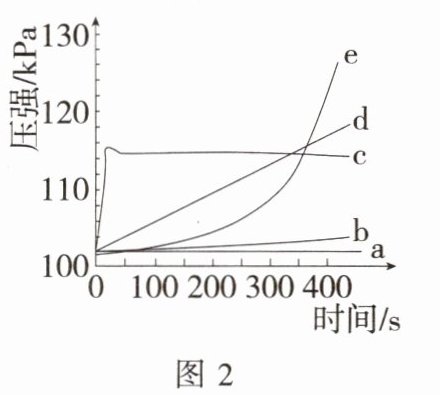
(1)曲线 a 对应的金属是
(2)曲线 b 对应的金属是铁,反应的化学方程式为
(3)曲线 c 在 18 s 左右达到最高点后又稍下降的原因是
(4)下列说法错误的是(
A. d 对应的金属与稀盐酸的反应速率适中,适用于实验室制取氢气
B. 从图 2 中 0~100 s 可推测 e 对应的金属打磨不彻底
C. 从图 2 中推测 250~450 s 时盐酸浓度变大


(1)曲线 a 对应的金属是
铜
。(2)曲线 b 对应的金属是铁,反应的化学方程式为
$Fe+2HCl=FeCl_{2}+H_{2}\uparrow$
。(3)曲线 c 在 18 s 左右达到最高点后又稍下降的原因是
镁与稀盐酸反应放热,18s左右反应结束后,装置温度降低
。(4)下列说法错误的是(
C
)(填字母)。A. d 对应的金属与稀盐酸的反应速率适中,适用于实验室制取氢气
B. 从图 2 中 0~100 s 可推测 e 对应的金属打磨不彻底
C. 从图 2 中推测 250~450 s 时盐酸浓度变大
答案:
答案 (1)铜 (2)$Fe+2HCl=FeCl_{2}+H_{2}\uparrow$ (3)镁与稀盐酸反应放热,18s左右反应结束后,装置温度降低 (4)C
解析 (1)曲线a压强不变,则对应的金属是铜。
(2)曲线b对应的金属是铁,铁与稀盐酸反应生成氯化亚铁和氢气。
(3)曲线c的压强变化最快,则对应的金属是镁,曲线c在18s左右达到最高点后又稍下降的原因是镁与稀盐酸反应放热,18s左右反应结束后,装置温度降低,瓶内压强下降。
(4)d对应的金属(锌)与稀盐酸的反应速率适中,适用于实验室制取氢气。e对应的金属为铝,0~100s时,稀盐酸与$Al_{2}O_{3}$反应生成氯化铝和水,压强基本不变。由图2可知,投入镁,250~450s时反应已结束,盐酸浓度不变;投入铜不发生反应,250~450s时盐酸浓度不变;投入铝、锌、铁,250~450s时随着反应的进行,盐酸浓度变小。
解析 (1)曲线a压强不变,则对应的金属是铜。
(2)曲线b对应的金属是铁,铁与稀盐酸反应生成氯化亚铁和氢气。
(3)曲线c的压强变化最快,则对应的金属是镁,曲线c在18s左右达到最高点后又稍下降的原因是镁与稀盐酸反应放热,18s左右反应结束后,装置温度降低,瓶内压强下降。
(4)d对应的金属(锌)与稀盐酸的反应速率适中,适用于实验室制取氢气。e对应的金属为铝,0~100s时,稀盐酸与$Al_{2}O_{3}$反应生成氯化铝和水,压强基本不变。由图2可知,投入镁,250~450s时反应已结束,盐酸浓度不变;投入铜不发生反应,250~450s时盐酸浓度不变;投入铝、锌、铁,250~450s时随着反应的进行,盐酸浓度变小。
8. 新课标 探究实践 久置的镁带表面会有一层灰黑色固体。为了测量久置镁带中金属镁的质量分数,同学们提出了两种实验方法:①物理方法,取一定质量的镁带,用砂纸打磨,除尽表面的灰黑色固体,根据剩余固体质量计算金属镁的质量分数;②化学方法,取一定质量的镁带,与足量的稀硫酸反应,根据测得生成气体的体积计算金属镁的质量分数。
(1)经讨论,同学们否定了物理方法。理由是:打磨过程中
(2)常温常压下氢气密度已知,因此大家认为化学方法可行。
老师提示:镁与稀硫酸反应放热;灰黑色固体除了氧化镁之外,还存在少量碱式碳酸镁$[MgCO_{3}\cdot Mg(OH)_{2}]$,它与酸反应会产生$CO_{2}$气体;碱石灰是 CaO 和 NaOH 的混合物。
同学们从下列装置中选择合适的装置,组装并进行实验。
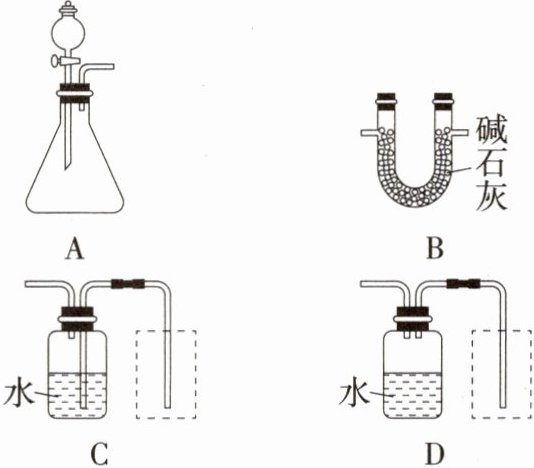
①图 C、D 虚线框内有一种测量体积的仪器(未画出),该仪器是
②完成该实验应选择的装置为
③结合实验方法和选择的装置分析,会造成实验结果不准确的是
A. 加入稀硫酸不足,镁带有剩余
B. 装置气密性不好
C. 反应结束,立即读数
(1)经讨论,同学们否定了物理方法。理由是:打磨过程中
容易把镁也打磨掉
。(2)常温常压下氢气密度已知,因此大家认为化学方法可行。
老师提示:镁与稀硫酸反应放热;灰黑色固体除了氧化镁之外,还存在少量碱式碳酸镁$[MgCO_{3}\cdot Mg(OH)_{2}]$,它与酸反应会产生$CO_{2}$气体;碱石灰是 CaO 和 NaOH 的混合物。
同学们从下列装置中选择合适的装置,组装并进行实验。

①图 C、D 虚线框内有一种测量体积的仪器(未画出),该仪器是
量筒
。②完成该实验应选择的装置为
ABC
(填字母)。③结合实验方法和选择的装置分析,会造成实验结果不准确的是
ABC
(填字母)。A. 加入稀硫酸不足,镁带有剩余
B. 装置气密性不好
C. 反应结束,立即读数
答案:
答案 (1)容易把镁也打磨掉 (2)①量筒 ②ABC ③ABC
解析 (2)①实验中排出的液体的体积即为生成的氢气的体积,而测量液体的体积应使用量筒。②由于镁带中有碱式碳酸镁存在,其与硫酸反应会产生二氧化碳气体,实验产生的氢气中会混有二氧化碳和水蒸气,而碱石灰能将两者吸收,故必须有B装置,另外A 为发生装置,C为测量体积的装置,故选ABC。③加入稀硫酸不足,镁带有剩余,会造成实验结果不准确;装置气密性不好,氢气逸出,会造成实验结果不准确;镁与稀硫酸反应放热,反应结束,立即读数,所测得氢气体积偏大,会造成实验结果不准确。
解析 (2)①实验中排出的液体的体积即为生成的氢气的体积,而测量液体的体积应使用量筒。②由于镁带中有碱式碳酸镁存在,其与硫酸反应会产生二氧化碳气体,实验产生的氢气中会混有二氧化碳和水蒸气,而碱石灰能将两者吸收,故必须有B装置,另外A 为发生装置,C为测量体积的装置,故选ABC。③加入稀硫酸不足,镁带有剩余,会造成实验结果不准确;装置气密性不好,氢气逸出,会造成实验结果不准确;镁与稀硫酸反应放热,反应结束,立即读数,所测得氢气体积偏大,会造成实验结果不准确。
查看更多完整答案,请扫码查看


