第23页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
5.「2025舟山五校质检」将一定量的铜铝混合粉末放入盛有硝酸银溶液的烧杯中,不断搅拌,充分反应后过滤。向得到的滤渣和滤液中分别加入足量的稀盐酸,均无现象。则滤渣中(
A.一定有银,可能有铜和铝
B.一定有银,可能有铜,一定没有铝
C.一定有银和铜,可能有铝
D.一定有银和铜,一定没有铝
B
)A.一定有银,可能有铜和铝
B.一定有银,可能有铜,一定没有铝
C.一定有银和铜,可能有铝
D.一定有银和铜,一定没有铝
答案:
5.B 金属活动性顺序:铝>铜>银,将一定量的铜铝混合粉末放入盛有硝酸银溶液的烧杯中,不断搅拌,铝先与硝酸银反应生成硝酸铝和银,当铝反应完后,若硝酸银还有剩余,铜再与硝酸银反应生成硝酸铜和银。
向滤渣和滤液中分别滴加稀盐酸均无明显现象产生,说明滤渣中不含金属Al,滤液中不含硝酸银,所以滤渣中一定含有银,可能含有铜,一定没有铝。
向滤渣和滤液中分别滴加稀盐酸均无明显现象产生,说明滤渣中不含金属Al,滤液中不含硝酸银,所以滤渣中一定含有银,可能含有铜,一定没有铝。
6.「2024湖南长沙开福期中」将一定量的锌粉加入硫酸亚铁、硫酸铜和硫酸镁的混合溶液中,一段时间后过滤,向滤渣中加入稀盐酸,有气泡产生。下列叙述中不正确的是( )
A.滤渣中一定含有铁,可能含有铜和锌
B.向滤渣中加入足量稀盐酸,最后溶液一定变成浅绿色
C.滤液中一定含有硫酸锌和硫酸镁
D.滤液的颜色可能为浅绿色
A.滤渣中一定含有铁,可能含有铜和锌
B.向滤渣中加入足量稀盐酸,最后溶液一定变成浅绿色
C.滤液中一定含有硫酸锌和硫酸镁
D.滤液的颜色可能为浅绿色
答案:
6.A 将一定量的锌粉加入硫酸亚铁、硫酸铜和硫酸镁的混合溶液中,锌与硫酸镁不反应,锌先与硫酸铜反应,硫酸铜完全反应后,若锌粉有剩余,会继续与硫酸亚铁反应。根据加入锌粉的质量,分析滤液、滤渣成分如下:

向滤渣中加入稀盐酸,有气泡产生,说明滤渣中一定含有铁、铜,无法确定是否含有锌;向滤渣中加入足量稀盐酸,稀盐酸、氯化锌溶液为无色,铁和稀盐酸反应生成氯化亚铁和氢气,溶液变为浅绿色;由上述分析可知,滤液中一定含有硫酸锌和硫酸镁;滤液中可能含有硫酸亚铁,滤液的颜色可能为浅绿色。
6.A 将一定量的锌粉加入硫酸亚铁、硫酸铜和硫酸镁的混合溶液中,锌与硫酸镁不反应,锌先与硫酸铜反应,硫酸铜完全反应后,若锌粉有剩余,会继续与硫酸亚铁反应。根据加入锌粉的质量,分析滤液、滤渣成分如下:

向滤渣中加入稀盐酸,有气泡产生,说明滤渣中一定含有铁、铜,无法确定是否含有锌;向滤渣中加入足量稀盐酸,稀盐酸、氯化锌溶液为无色,铁和稀盐酸反应生成氯化亚铁和氢气,溶液变为浅绿色;由上述分析可知,滤液中一定含有硫酸锌和硫酸镁;滤液中可能含有硫酸亚铁,滤液的颜色可能为浅绿色。
7.「2024金华金东期中」向$Cu(NO_3)_2、$$Al(NO_3)_3$和$AgNO_3$的混合溶液中加入一定量铁粉,充分反应后过滤,向滤渣中滴加稀硫酸时有气泡产生。下列推断正确的是(
A.滤渣中一定有铁、铜、银,可能有铝
B.滤液中的溶质只有$Al(NO_3)_3$和$Fe(NO_3)_2$
C.滤液中一定有$Fe(NO_3)_2,$可能有$Al(NO_3)_3$
D.滤液中一定有$Al(NO_3)_3$和$Fe(NO_3)_2,$可能有$Cu(NO_3)_2$
B
)A.滤渣中一定有铁、铜、银,可能有铝
B.滤液中的溶质只有$Al(NO_3)_3$和$Fe(NO_3)_2$
C.滤液中一定有$Fe(NO_3)_2,$可能有$Al(NO_3)_3$
D.滤液中一定有$Al(NO_3)_3$和$Fe(NO_3)_2,$可能有$Cu(NO_3)_2$
答案:
7.B 金属活动性顺序:铝>铁>铜>银,向含有$AgNO_3$、$Cu(NO_3)_2$、$Al(NO_3)_3$的混合溶液中加入一定量的铁粉,铁粉首先置换硝酸银中的银,待硝酸银完全反应后,若铁粉有剩余,铁粉再与硝酸铜发生反应,铁粉不与硝酸铝发生反应。向滤渣中滴加稀硫酸,有气泡产生,说明滤渣中有铁粉,即所加的铁粉过量,原混合溶液中的银和铜全部被置换出来,滤渣中一定有铁、铜、银,一定没有铝,滤液中的溶质有生成的$Fe(NO_3)_2$和不参加反应的$Al(NO_3)_3$。
8.「2024黑龙江齐齐哈尔中考」将一定质量的铁粉放入硝酸锌和硝酸银的混合溶液中,充分反应后过滤,得到滤渣和滤液。下列说法正确的是(
A.若滤液呈浅绿色,则滤液中只含有硝酸亚铁
B.若滤渣中的成分能被磁铁吸引,则滤渣中一定含有两种金属
C.若向滤液中加入锌片,有固体析出,则滤液中一定含有硝酸银
D.将所得滤渣洗涤、干燥后称量,质量可能与所加铁粉的质量相等
B
)A.若滤液呈浅绿色,则滤液中只含有硝酸亚铁
B.若滤渣中的成分能被磁铁吸引,则滤渣中一定含有两种金属
C.若向滤液中加入锌片,有固体析出,则滤液中一定含有硝酸银
D.将所得滤渣洗涤、干燥后称量,质量可能与所加铁粉的质量相等
答案:
8.B 铁不能和硝酸锌反应,铁和硝酸银反应生成硝酸亚铁和银,充分反应后滤液中一定含有生成的硝酸亚铁和不参与反应的硝酸锌,A错误;若滤渣中的成分能被磁铁吸引,则滤渣中有剩余的铁,所以滤渣中一定含有铁和生成的银两种金属,B正确;锌可以和硝酸亚铁反应生成铁和硝酸锌,若向滤液中加入锌片,有固体析出,不能说明滤液中一定含有硝酸银,C错误;铁和硝酸银反应生成硝酸亚铁和银,由反应的化学方程式$Fe + 2AgNO_3══Fe(NO_3)_2 + 2Ag$可知,每56份质量的铁完全反应能置换出216份质量的银,反应后固体质量变大,所以将所得滤渣洗涤、干燥后称量,质量一定大于所加铁粉的质量,D错误。
9.「2025杭州观成教育集团期中」向一定质量的$Mg(NO_3)_2$和$Cu(NO_3)_2$混合溶液中加入a克锌粉和铁粉的混合物,充分反应后过滤,得到不饱和的滤液和滤渣,将滤渣洗涤、干燥后再称量,得到的固体质量仍为a克。下列分析合理的是(
①滤渣中可能有铜
②向滤渣中加稀盐酸,可能有气泡产生
③滤液中一定有$Mg(NO_3)_2、$$Zn(NO_3)_2$和$Fe(NO_3)_2,$可能有$Cu(NO_3)_2$
④若忽略过滤操作中溶液损失,滤液中溶质的质量一定大于原混合溶液中溶质的质量
A.①②
B.①③
C.②③
D.②④
C
)①滤渣中可能有铜
②向滤渣中加稀盐酸,可能有气泡产生
③滤液中一定有$Mg(NO_3)_2、$$Zn(NO_3)_2$和$Fe(NO_3)_2,$可能有$Cu(NO_3)_2$
④若忽略过滤操作中溶液损失,滤液中溶质的质量一定大于原混合溶液中溶质的质量
A.①②
B.①③
C.②③
D.②④
答案:
9.C 向一定质量的$Mg(NO_3)_2$和$Cu(NO_3)_2$的混合溶液中加入a克锌粉和铁粉的混合物,硝酸镁不参加反应,硝酸铜先和锌反应生成硝酸锌和铜,反应后固体质量减小,待混合物中的锌粉完全反应后,硝酸铜再和铁反应生成硝酸亚铁和铜,反应后固体质量增大,现充分反应后得到的固体质量仍为a克,说明锌完全反应,铁部分或全部反应。滤渣中一定有铜,①不正确;向滤渣中加稀盐酸,可能有气泡产生,例如铁过量时,②正确;滤液中一定有不参加反应的$Mg(NO_3)_2$、反应生成的$Zn(NO_3)_2$和$Fe(NO_3)_2$,可能有$Cu(NO_3)_2$(过量时),③正确;若忽略过滤操作中溶液损失,滤液中溶质的质量一定等于原混合溶液中溶质的质量,因为加入a克锌粉和铁粉后得到的固体质量仍为a克,即反应前后固体质量相等,根据质量守恒定律,滤液中溶质的质量一定等于原混合溶液中溶质的质量,④错误。
10.「2024金华兰溪实验中学段考」在5.6g铁粉中,先逐滴加入$M_1gCu(NO_3)_2$溶液,充分反应后再逐滴加入$AgNO_3$溶液,剩余固体质量(生成的溶质形成的溶液均未达到饱和状态)与所加溶液总质量的关系如图所示。
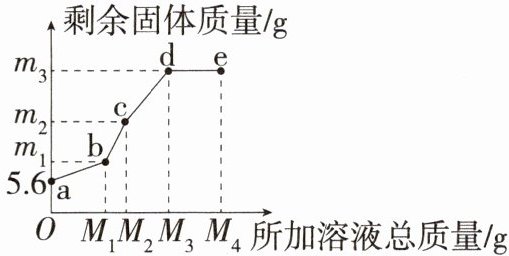
请根据题目所给信息回答下列问题:
(1)写出ab段发生反应的化学方程式:
(2)e点对应的固体为
(3)若c点所得溶液质量为100克,请计算c点溶液的溶质质量分数。
解:c点溶液中,溶质为硝酸亚铁,设硝酸亚铁的质量为x。
$Fe~Fe(NO_3)_2$
56 180
5.6g x
$\frac{56}{180}=\frac{5.6g}{x}$ x = 18g
c点溶液的溶质质量分数为$\frac{18g}{100g}×100\% = 18\%$。
答:c点溶液的溶质质量分数为18%。

请根据题目所给信息回答下列问题:
(1)写出ab段发生反应的化学方程式:
$Fe + Cu(NO_3)_2══Cu + Fe(NO_3)_2$
。(2)e点对应的固体为
Ag
,e点对应溶液中的溶质有3
种。(3)若c点所得溶液质量为100克,请计算c点溶液的溶质质量分数。
解:c点溶液中,溶质为硝酸亚铁,设硝酸亚铁的质量为x。
$Fe~Fe(NO_3)_2$
56 180
5.6g x
$\frac{56}{180}=\frac{5.6g}{x}$ x = 18g
c点溶液的溶质质量分数为$\frac{18g}{100g}×100\% = 18\%$。
答:c点溶液的溶质质量分数为18%。
答案:
10.答案
(1)$Fe + Cu(NO_3)_2══Cu + Fe(NO_3)_2$
(2)Ag 3
(3)解:c点溶液中,溶质为硝酸亚铁,设硝酸亚铁的质量为x。
$Fe~Fe(NO_3)_2$
56 180
5.6g x
$\frac{56}{180}=\frac{5.6g}{x}$ x = 18g
c点溶液的溶质质量分数为$\frac{18g}{100g}×100\% = 18\%$。
答:c点溶液的溶质质量分数为18%。
解析 在5.6g铁粉中,先逐滴加入$M_1$克$Cu(NO_3)_2$溶液,则铁与硝酸铜反应生成硝酸亚铁和铜,ab段为铁与硝酸铜的反应。根据图像分析,加入硝酸银溶液后反应出现两个拐点,则是硝酸银与两种金属发生反应,即分别和铁与铜反应,所以b点时铁粉有剩余,b点固体为铁和铜,溶液中溶质为硝酸亚铁而无硝酸铜。逐滴加入$AgNO_3$溶液过程中,铁先与硝酸银反应生成硝酸亚铁和银,铁完全反应后,铜再与硝酸银反应生成银和硝酸铜,所以bc段是铁与硝酸银反应,cd段是铜与硝酸银反应。最后加入的硝酸银过量,e点溶液中有生成的硝酸亚铁、硝酸铜以及过量的硝酸银,e点剩余固体仅为银。
(1)$Fe + Cu(NO_3)_2══Cu + Fe(NO_3)_2$
(2)Ag 3
(3)解:c点溶液中,溶质为硝酸亚铁,设硝酸亚铁的质量为x。
$Fe~Fe(NO_3)_2$
56 180
5.6g x
$\frac{56}{180}=\frac{5.6g}{x}$ x = 18g
c点溶液的溶质质量分数为$\frac{18g}{100g}×100\% = 18\%$。
答:c点溶液的溶质质量分数为18%。
解析 在5.6g铁粉中,先逐滴加入$M_1$克$Cu(NO_3)_2$溶液,则铁与硝酸铜反应生成硝酸亚铁和铜,ab段为铁与硝酸铜的反应。根据图像分析,加入硝酸银溶液后反应出现两个拐点,则是硝酸银与两种金属发生反应,即分别和铁与铜反应,所以b点时铁粉有剩余,b点固体为铁和铜,溶液中溶质为硝酸亚铁而无硝酸铜。逐滴加入$AgNO_3$溶液过程中,铁先与硝酸银反应生成硝酸亚铁和银,铁完全反应后,铜再与硝酸银反应生成银和硝酸铜,所以bc段是铁与硝酸银反应,cd段是铜与硝酸银反应。最后加入的硝酸银过量,e点溶液中有生成的硝酸亚铁、硝酸铜以及过量的硝酸银,e点剩余固体仅为银。
查看更多完整答案,请扫码查看


