第8页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
1. 下列物质属于盐的是 (
A. $Ca(OH)_2$
B. $CuSO_4$
C. $Na_2O$
D. $HNO_3$
B
)A. $Ca(OH)_2$
B. $CuSO_4$
C. $Na_2O$
D. $HNO_3$
答案:
B $Ca(OH)_2$属于碱;$CuSO_4$属于盐;$Na_2O$属于氧化物;$HNO_3$属于酸。
2. 下列有关$NaCl$、$NaHCO_3$、$Na_2CO_3$、$CaCO_3$四种常见盐的俗称和主要成分的描述,错误的是 (
A. $NaCl$:食盐
B. $NaHCO_3$:小苏打
C. $Na_2CO_3$:烧碱
D. $CaCO_3$:石灰石
C
)A. $NaCl$:食盐
B. $NaHCO_3$:小苏打
C. $Na_2CO_3$:烧碱
D. $CaCO_3$:石灰石
答案:
C $Na_2CO_3$俗称纯碱,烧碱是$NaOH$的俗称。
3. 「2025温州乐清山海联盟期中」食盐是生活中不可缺少的一种物质,也是科学学习中重要的盐。以下不属于食盐用途的是 (
A. 厨房调味品
B. 制作腌制品
C. 配制生理盐水
D. 制取二氧化碳
D
)A. 厨房调味品
B. 制作腌制品
C. 配制生理盐水
D. 制取二氧化碳
答案:
D 食盐可用作厨房调味品;食盐可用于制作腌制品;食盐提纯后得到的氯化钠可用于配制生理盐水;食盐不能用于制取二氧化碳。
4. 下列关于氯化钠的认识,不正确的是 (
A. 构成:由氯化钠分子构成
B. 性质:能与硝酸银溶液反应产生白色沉淀
C. 用途:可用于配制生理盐水
D. 生产:沿海地区常通过蒸发海水获得
A
)A. 构成:由氯化钠分子构成
B. 性质:能与硝酸银溶液反应产生白色沉淀
C. 用途:可用于配制生理盐水
D. 生产:沿海地区常通过蒸发海水获得
答案:
A 氯化钠由氯离子、钠离子构成,A不正确;氯化钠溶液能与硝酸银溶液反应生成白色的氯化银沉淀和硝酸钠,B正确;生理盐水是$0.9\%$的氯化钠溶液,C正确;氯化钠的溶解度受温度变化影响较小,沿海地区常通过蒸发海水获得氯化钠,D正确。
5. 下列有关常见盐用途的说法中,错误的是 (
A. 氯化钠可用于治疗胃酸过多
B. 碳酸钙是常见的建筑材料
C. 碳酸钠可用于造纸、纺织
D. 碳酸氢钠可用于焙制糕点
A
)A. 氯化钠可用于治疗胃酸过多
B. 碳酸钙是常见的建筑材料
C. 碳酸钠可用于造纸、纺织
D. 碳酸氢钠可用于焙制糕点
答案:
A 要治疗胃酸过多,必须减少胃酸中氢离子的含量,氯化钠不能与氢离子发生反应,故其并不能用来治疗胃酸过多。
6. 有人用石灰乳刷墙,开始时墙面变得潮湿,过几天墙面就变得又硬又白了,涉及的反应原理为$Ca(OH)_2 + CO_2 = CaCO_3 \downarrow + H_2O$。下列说法中,正确的是 (
A. 刷墙所用的石灰乳属于溶液,其溶质是氢氧化钙
B. 氢氧化钙俗称熟石灰,常温下分解可得到生石灰
C. 一段时间后,墙面表层物质的pH比其内层物质的pH大
D. 为了验证碳酸盐的生成,可用稀盐酸、澄清石灰水进行检验
D
)A. 刷墙所用的石灰乳属于溶液,其溶质是氢氧化钙
B. 氢氧化钙俗称熟石灰,常温下分解可得到生石灰
C. 一段时间后,墙面表层物质的pH比其内层物质的pH大
D. 为了验证碳酸盐的生成,可用稀盐酸、澄清石灰水进行检验
答案:
D 刷墙所用的石灰乳不具有均一、稳定的特征,不属于溶液,A错误;氢氧化钙常温下不易分解,B错误;一段时间后,墙面表层变成了碳酸钙,不溶于水,其内层物质可能仍含氢氧化钙,显碱性,pH较表层大,C错误;稀盐酸可与碳酸盐反应产生二氧化碳,澄清石灰水与二氧化碳反应能产生沉淀,故可用稀盐酸、澄清石灰水检验碳酸盐的生成,D正确。
7. 「2024温州二模」小科学习了常见的四种盐:氯化钠($NaCl$)、碳酸钠($Na_2CO_3$)、碳酸氢钠($NaHCO_3$)、碳酸钙($CaCO_3$)后,对它们的部分性质进行归纳整理并编制了检索表(如图)。检索表中M代表的是 (
检索表
1a 不溶于水························P
1b 可溶于水························2
2a 加热不稳定,易分解········Q
2b 加热不分解······················3
3a 与酸反应产生气泡········M
3b 不与酸发生反应··············N
A. $NaCl$
B. $Na_2CO_3$
C. $NaHCO_3$
D. $CaCO_3$
B
)检索表
1a 不溶于水························P
1b 可溶于水························2
2a 加热不稳定,易分解········Q
2b 加热不分解······················3
3a 与酸反应产生气泡········M
3b 不与酸发生反应··············N
A. $NaCl$
B. $Na_2CO_3$
C. $NaHCO_3$
D. $CaCO_3$
答案:
B 由表中信息可知,M具有的性质是能与酸反应产生气泡、加热不分解、可溶于水,在氯化钠、碳酸钠、碳酸氢钠、碳酸钙四种物质中,氯化钠不与酸反应,碳酸氢钠受热会分解,碳酸钙难溶于水,则M代表的是碳酸钠。
8. 「★☆」有一包白色粉末可能由碳酸钠、硫酸钠、氯化钠、氯化钡中的一种或几种组成。把少量该粉末放入足量水中,搅拌、静置、过滤,得到白色固体和滤液。向所得固体中加入足量稀硝酸充分反应,固体部分溶解,关于这包白色粉末,下列说法正确的是 (
A. 一定有碳酸钠、硫酸钠、氯化钡,一定无氯化钠
B. 一定有碳酸钠、氯化钡、氯化钠
C. 一定有碳酸钠、硫酸钠、氯化钡,可能有氯化钠
D. 一定有硫酸钠、氯化钡,一定无氯化钠
C
)A. 一定有碳酸钠、硫酸钠、氯化钡,一定无氯化钠
B. 一定有碳酸钠、氯化钡、氯化钠
C. 一定有碳酸钠、硫酸钠、氯化钡,可能有氯化钠
D. 一定有硫酸钠、氯化钡,一定无氯化钠
答案:
C 碳酸钡不溶于水,能与稀硝酸反应;硫酸钡不溶于水,也不溶于稀硝酸。向白色固体中加入足量稀硝酸充分反应,固体部分溶解,说明白色固体是碳酸钡和硫酸钡的混合物,可推断白色粉末中一定有碳酸钠、硫酸钠和氯化钡,但不确定是否有氯化钠,故选C。
9. 「★☆」及时归纳是学好科学的主要方法之一。利用如图所示的结构图归纳盐的四个方面的化学性质(图中编号①~④),请回答下列问题。
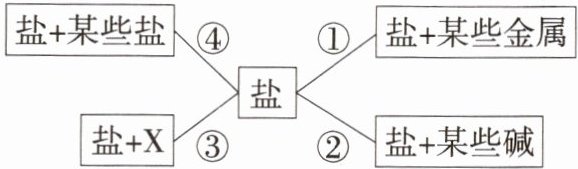
(1) 在归纳性质②时,选取了硫酸铜和氢氧化钠两种物质,它们在溶液中反应时产生的现象为
(2) 在性质③中,X代表
(3) 在归纳性质④时,从“某些盐”中选取了硝酸银,写出一个有硝酸银参与的反应的化学方程式:

(1) 在归纳性质②时,选取了硫酸铜和氢氧化钠两种物质,它们在溶液中反应时产生的现象为
产生蓝色沉淀,溶液由蓝色逐渐变为无色
,反应的化学方程式为2NaOH + CuSO₄ = Na₂SO₄ + Cu(OH)₂↓
。(2) 在性质③中,X代表
某些酸
。(3) 在归纳性质④时,从“某些盐”中选取了硝酸银,写出一个有硝酸银参与的反应的化学方程式:
NaCl + AgNO₃ = NaNO₃ + AgCl↓
。
答案:
答案 (1)产生蓝色沉淀,溶液由蓝色逐渐变为无色 $2NaOH + CuSO_4 = Na_2SO_4 + Cu(OH)_2 \downarrow$ (2)某些酸 (3)$NaCl + AgNO_3 = NaNO_3 + AgCl \downarrow$(合理即可)
解析 (1)硫酸铜和氢氧化钠反应生成氢氧化铜沉淀和硫酸钠,现象是产生蓝色沉淀,溶液由蓝色逐渐变为无色。(2)由盐的化学性质可知,盐可以和某些酸反应生成新酸和新盐。
解析 (1)硫酸铜和氢氧化钠反应生成氢氧化铜沉淀和硫酸钠,现象是产生蓝色沉淀,溶液由蓝色逐渐变为无色。(2)由盐的化学性质可知,盐可以和某些酸反应生成新酸和新盐。
查看更多完整答案,请扫码查看


