第46页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
10.(2025·沧州月考)如图为铝原子结构示意图。下列有关铝原子的说法正确的是()
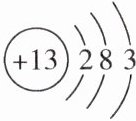
A.图中“+”表示铝原子带正电
B.铝原子的中子数为13
C.铝原子在化学反应中易得到电子
D.铝原子核外有3个电子层

A.图中“+”表示铝原子带正电
B.铝原子的中子数为13
C.铝原子在化学反应中易得到电子
D.铝原子核外有3个电子层
答案:
D 解析:原子结构示意图中,圆圈中的“+”表示原子核带正电,原子不显电性,A错误;原子的质子数=核外电子数,但不一定等于中子数,圆圈内的“13”表示质子数,而不是中子数,B错误;铝原子最外层电子数为3,小于4,在化学反应中易失去电子,C错误;由图可知,铝原子核外有3个电子层,D正确。
11.(2025·聊城月考)化学上可用符号“$_{Z}^{A}M$”表示原子的组成,其中M代表元素符号,Z表示原子核内的质子数,A表示原子核内质子数与中子数之和。已知$_{a}^{b}X^{n+}和_{c}^{d}Y^{m-}$的核外电子排布完全相同,则下列关系正确的是 ()
A.$b-a= d-c$
B.$a-n= c+m$
C.$a+n= c-m$
D.$b-n= d+m$
A.$b-a= d-c$
B.$a-n= c+m$
C.$a+n= c-m$
D.$b-n= d+m$
答案:
B 解析:由题干信息可知两种离子的核外电子排布完全相同,则$_{a}^{b}X^{n+}$、$_{c}^{d}Y^{m-}$的核外电子排布完全相同,即核外电子数相等。$_{a}^{b}X^{n+}$中质子数为a,则核外电子数为$a - n$,$_{c}^{d}Y^{m-}$中质子数为c,则核外电子数为$c + m$,则有$a - n = c + m$。
12.有一个带电的离子含有X、Y、Z三种微观粒子(质子、电子、中子,未依照顺序排列),且X、Y、Z的微观粒子数目依次为$N_{X}$、$N_{Y}$、$N_{Z}$。已知微观粒子X的质量最小。关于此离子的说法正确的是 ()
A.若为阳离子,且$N_{Y}>N_{X}= N_{Z}$,则Z为质子
B.若为阳离子,且$N_{Y}>N_{X}= N_{Z}$,则Z为电子
C.若为阴离子,且$N_{X}= N_{Y}>N_{Z}$,则Z为质子
D.若为阴离子,且$N_{X}>N_{Y}= N_{Z}$,则Z为电子
A.若为阳离子,且$N_{Y}>N_{X}= N_{Z}$,则Z为质子
B.若为阳离子,且$N_{Y}>N_{X}= N_{Z}$,则Z为电子
C.若为阴离子,且$N_{X}= N_{Y}>N_{Z}$,则Z为质子
D.若为阴离子,且$N_{X}>N_{Y}= N_{Z}$,则Z为电子
答案:
C 解析:由题意可知,一个带电的离子含有X、Y、Z三种微观粒子(质子、电子、中子,未依照顺序排列),已知微观粒子X的质量最小,则X为电子,由此可知:若为阳离子,质子数大于核外电子数,且$N_{Y}>N_{X}=N_{Z}$,所以Y为质子,X 为电子,Z为中子,故A、B说法错误;若为阴离子,质子数小于核外电子数,且$N_{X}=N_{Y}>N_{Z}$,X为电子,则Y为中子,Z为质子,C项说法正确;若为阴离子,质子数小于核外电子数,且$N_{X}>N_{Y}=N_{Z}$,Y、Z为质子和中子,D项说法错误。
13.从镍氢电池到锂电池,再到钠电池、钾电池,科学家在不断提升电池的性能。
(1)金属原子失去电子后形成______(填“阴”或“阳”)离子,锂、钠、钾等金属很容易失去电子,所以常被用作电池材料。
(2)研究表明,半径越大的金属离子越容易在电池正负极之间移动,充电速度越快。如图是锂、钠、钾三种金属的离子半径大小,电池容量相同的这三种电池,充满电的时间最短的是______离子电池。

(1)金属原子失去电子后形成______(填“阴”或“阳”)离子,锂、钠、钾等金属很容易失去电子,所以常被用作电池材料。
(2)研究表明,半径越大的金属离子越容易在电池正负极之间移动,充电速度越快。如图是锂、钠、钾三种金属的离子半径大小,电池容量相同的这三种电池,充满电的时间最短的是______离子电池。

答案:
(1)阳
(2)钾
解析:
(1)电子带负电,金属原子失去电子后形成带正电荷的阳离子。
(2)研究表明,半径越大的金属离子越容易在电池正负极之间移动,充电速度越快,由锂、钠、钾三种金属的离子半径大小可知,钾离子的半径最大,电池容量相同的这三种电池,充满电的时间最短的是钾离子电池。
(1)阳
(2)钾
解析:
(1)电子带负电,金属原子失去电子后形成带正电荷的阳离子。
(2)研究表明,半径越大的金属离子越容易在电池正负极之间移动,充电速度越快,由锂、钠、钾三种金属的离子半径大小可知,钾离子的半径最大,电池容量相同的这三种电池,充满电的时间最短的是钾离子电池。
14.(2024·无锡月考节选)结构决定性质,性质决定应用。微观探析是化学学习的特有方式。某粒子(原子或离子)的结构示意图如图所示。
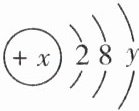
(1)若$x= 12$,当$y= $______时,该粒子是原子。
(2)若该粒子带两个单位负电荷,且$y= 8$,则该粒子的符号为______。
(3)若$x-y<10$,则该粒子是______(填“原子”“阳离子”或“阴离子”)。
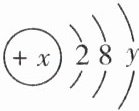
(1)若$x= 12$,当$y= $______时,该粒子是原子。
(2)若该粒子带两个单位负电荷,且$y= 8$,则该粒子的符号为______。
(3)若$x-y<10$,则该粒子是______(填“原子”“阳离子”或“阴离子”)。
答案:
(1)2
(2)$S^{2-}$
(3)阴离子
解析:
(1)在原子中,原子的质子数=核外电子数,若$x = 12$,当$y = 12 - 2 - 8 = 2$时,该粒子是原子。
(2)若该粒子带两个单位负电荷,且$y = 8$,则核内的质子数是16,核外的电子数是18,则该粒子是硫离子,其符号为$S^{2-}$。
(3)若$x - y < 10$,即$x < y + 10$,则该粒子是阴离子。
(1)2
(2)$S^{2-}$
(3)阴离子
解析:
(1)在原子中,原子的质子数=核外电子数,若$x = 12$,当$y = 12 - 2 - 8 = 2$时,该粒子是原子。
(2)若该粒子带两个单位负电荷,且$y = 8$,则核内的质子数是16,核外的电子数是18,则该粒子是硫离子,其符号为$S^{2-}$。
(3)若$x - y < 10$,即$x < y + 10$,则该粒子是阴离子。
15.思想方法分析法 有A、B、C、D、E五种元素,A是相对原子质量最小的元素,B的次外层电子数占电子总数的$\frac {1}{4}$;$C^{2+}$比B原子多2个电子;D和C具有相同的电子层数,$D^{-}$的离子结构与氩原子结构相同;E和B具有相同的最外层电子数,但比B多一层电子。
(1)写出A、B、C、D、E五种元素的元素符号。
A:______、B:______、C:______、D:______、E:______。
(2)画出$D^{-}$的离子结构示意图:______。
(3)画出B的原子结构示意图:______。
(4)决定A、B、C、D、E五种元素化学性质不同的主要微观原因是______。
(1)写出A、B、C、D、E五种元素的元素符号。
A:______、B:______、C:______、D:______、E:______。
(2)画出$D^{-}$的离子结构示意图:______。
(3)画出B的原子结构示意图:______。
(4)决定A、B、C、D、E五种元素化学性质不同的主要微观原因是______。
答案:
(1)H O Mg Cl S
(2)
(3)
解析:
(1)相对原子质量最小的元素是氢,故A为H;B的次外层电子数占电子总数的$\frac{1}{4}$,说明B的次外层应该是第一层,电子总数是8,所以B为O元素;O原子有8个电子,C的阳离子$C^{2+}$比B原子多2个电子,是10个电子,所以C原子有12个电子,故C为Mg元素;$D^{-}$的离子结构与氩原子结构相同,也是18个电子,所以D原子有17个电子,所以D是Cl元素;E和B具有相同的最外层电子数,也就是最外层有6个电子,但比B多一层电子,也就是有3个电子层,E元素的电子数为16,故E是S元素。
(2)微粒$D^{-}$即$Cl^{-}$的结构示意图为 。
。
(3)B为氧原子,氧原子的结构示意图为
(4)元素的化学性质跟它的原子的最外层电子数目关系非常密切,原子的最外层电子数相同的元素化学性质相似,最外层电子数不同的元素化学性质不同。
(1)H O Mg Cl S
(2)

(3)

解析:
(1)相对原子质量最小的元素是氢,故A为H;B的次外层电子数占电子总数的$\frac{1}{4}$,说明B的次外层应该是第一层,电子总数是8,所以B为O元素;O原子有8个电子,C的阳离子$C^{2+}$比B原子多2个电子,是10个电子,所以C原子有12个电子,故C为Mg元素;$D^{-}$的离子结构与氩原子结构相同,也是18个电子,所以D原子有17个电子,所以D是Cl元素;E和B具有相同的最外层电子数,也就是最外层有6个电子,但比B多一层电子,也就是有3个电子层,E元素的电子数为16,故E是S元素。
(2)微粒$D^{-}$即$Cl^{-}$的结构示意图为
 。
。(3)B为氧原子,氧原子的结构示意图为

(4)元素的化学性质跟它的原子的最外层电子数目关系非常密切,原子的最外层电子数相同的元素化学性质相似,最外层电子数不同的元素化学性质不同。
查看更多完整答案,请扫码查看


