第108页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
- 第101页
- 第102页
- 第103页
- 第104页
- 第105页
- 第106页
- 第107页
- 第108页
- 第109页
- 第110页
- 第111页
- 第112页
6.某兴趣小组发现铁钉生锈需要几天的时间,询问老师如何加快铁钉生锈的速率。老师说氯化物可能加快铁钉生锈的速率。大家将铁钉放入加有氯化铜溶液的蒸馏水中。观察到7分钟时铁钉表面出现红色,20分钟后试管底部出现红色沉淀(盐酸可与金属氧化物发生反应,生成水和相应的金属氯化物)。
【提出问题】红色沉淀物是什么?
【作出猜想】小明认为可能是铁锈,写出铁锈主要成分的化学式:______。
小陈认为可能是铜。
小陈认为红色沉淀物是铜的理由是______(用文字描述)。
【设计实验】

(1)根据实验现象,红色沉淀物中一定含有铁锈,原因是______(用化学方程式表示);经过讨论,同学们一致认为红色沉淀物是铁锈和铜的混合物。
【继续探究】影响铁锈蚀的因素有哪些?
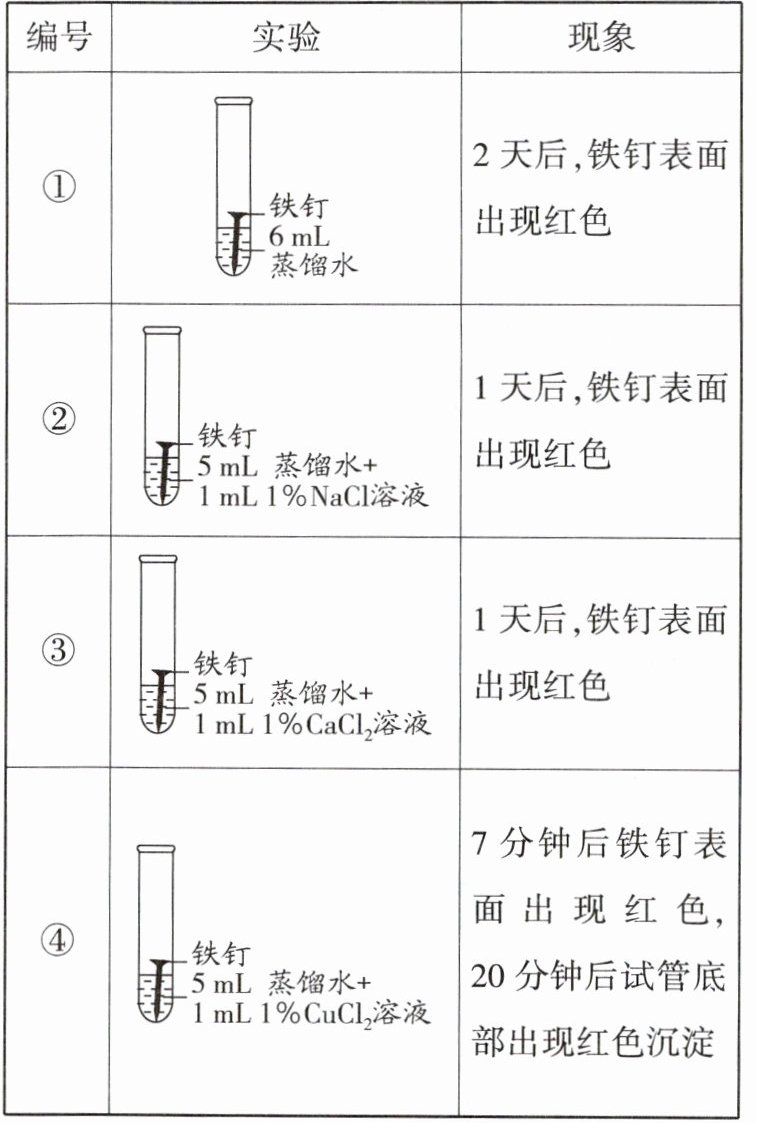
|编号|实验|现象|
|--|--|--|
|①||2天后,铁钉表面出现红色|
|②||1天后,铁钉表面出现红色|
|③||1天后,铁钉表面出现红色|
|④||7分钟后铁钉表面出现红色,20分钟后试管底部出现红色沉淀|
(2)实验①的作用是______。
(3)根据上述实验可以得到的结论是______。
(4)根据上述实验,沿海地区铁制品易锈蚀除因空气潮湿外,还可能的原因是______。
(5)影响铁制品锈蚀快慢除上述因素外,还有______(写一点即可),请设计实验方案进行验证:______。

【提出问题】红色沉淀物是什么?
【作出猜想】小明认为可能是铁锈,写出铁锈主要成分的化学式:______。
小陈认为可能是铜。
小陈认为红色沉淀物是铜的理由是______(用文字描述)。
【设计实验】

(1)根据实验现象,红色沉淀物中一定含有铁锈,原因是______(用化学方程式表示);经过讨论,同学们一致认为红色沉淀物是铁锈和铜的混合物。
【继续探究】影响铁锈蚀的因素有哪些?

|编号|实验|现象|
|--|--|--|
|①||2天后,铁钉表面出现红色|
|②||1天后,铁钉表面出现红色|
|③||1天后,铁钉表面出现红色|
|④||7分钟后铁钉表面出现红色,20分钟后试管底部出现红色沉淀|
(2)实验①的作用是______。
(3)根据上述实验可以得到的结论是______。
(4)根据上述实验,沿海地区铁制品易锈蚀除因空气潮湿外,还可能的原因是______。
(5)影响铁制品锈蚀快慢除上述因素外,还有______(写一点即可),请设计实验方案进行验证:______。

答案:
【作出猜想】$Fe_{2}O_{3}$ 铁能和氯化铜反应生成氯化亚铁和铜
【设计实验】
(1)$Fe_{2}O_{3} + 6HCl = 2FeCl_{3} + 3H_{2}O$
(2)对比实验
(3)氯化物能加快铁钉生锈的速率
(4)盐的存在
(5)氧气的浓度 取相同的铁钉放入两支试管中,加入等体积的水浸泡铁钉,在试管内分别通入等体积的空气和氧气,然后观察铁钉生锈所用的时间
解析:【作出猜想】铁锈的主要成分是氧化铁,其化学式为$Fe_{2}O_{3}$。铁的活动性大于铜,铁能和氯化铜反应生成氯化亚铁和铜,所以红色沉淀物可能是铜。【设计实验】
(1)铁锈的主要成分是氧化铁,能与盐酸反应生成氯化铁和水,化学方程式为$Fe_{2}O_{3} + 6HCl = 2FeCl_{3} + 3H_{2}O$。
(2)实验①中只有铁钉和蒸馏水,其余三支试管中是铁钉与盐溶液,所以实验①起到了对比的作用。
(3)依据控制变量法的操作可知,实验①中2天后,铁钉表面出现红色,实验②、③中1天后,铁钉表面出现红色,所以对比实验①②③可以得到的结论是氯化物能加快铁钉生锈的速率。
(4)氯化钠和氯化钙属于盐,由实验现象可知,沿海地区铁制品易锈蚀除因空气潮湿外,还可能的原因是盐的存在。
(5)影响铁制品锈蚀快慢除上述因素外,还有氧气的浓度,设计的实验方案是取相同的铁钉放入两支试管中,加入等体积的水浸泡铁钉,在试管内分别通入等体积的空气和氧气,然后观察铁钉生锈所用的时间。
【设计实验】
(1)$Fe_{2}O_{3} + 6HCl = 2FeCl_{3} + 3H_{2}O$
(2)对比实验
(3)氯化物能加快铁钉生锈的速率
(4)盐的存在
(5)氧气的浓度 取相同的铁钉放入两支试管中,加入等体积的水浸泡铁钉,在试管内分别通入等体积的空气和氧气,然后观察铁钉生锈所用的时间
解析:【作出猜想】铁锈的主要成分是氧化铁,其化学式为$Fe_{2}O_{3}$。铁的活动性大于铜,铁能和氯化铜反应生成氯化亚铁和铜,所以红色沉淀物可能是铜。【设计实验】
(1)铁锈的主要成分是氧化铁,能与盐酸反应生成氯化铁和水,化学方程式为$Fe_{2}O_{3} + 6HCl = 2FeCl_{3} + 3H_{2}O$。
(2)实验①中只有铁钉和蒸馏水,其余三支试管中是铁钉与盐溶液,所以实验①起到了对比的作用。
(3)依据控制变量法的操作可知,实验①中2天后,铁钉表面出现红色,实验②、③中1天后,铁钉表面出现红色,所以对比实验①②③可以得到的结论是氯化物能加快铁钉生锈的速率。
(4)氯化钠和氯化钙属于盐,由实验现象可知,沿海地区铁制品易锈蚀除因空气潮湿外,还可能的原因是盐的存在。
(5)影响铁制品锈蚀快慢除上述因素外,还有氧气的浓度,设计的实验方案是取相同的铁钉放入两支试管中,加入等体积的水浸泡铁钉,在试管内分别通入等体积的空气和氧气,然后观察铁钉生锈所用的时间。
查看更多完整答案,请扫码查看


