2025年资源与评价黑龙江教育出版社高中化学必修第二册人教版
注:目前有些书本章节名称可能整理的还不是很完善,但都是按照顺序排列的,请同学们按照顺序仔细查找。练习册 2025年资源与评价黑龙江教育出版社高中化学必修第二册人教版 答案主要是用来给同学们做完题方便对答案用的,请勿直接抄袭。
第60页
- 第1页
- 第2页
- 第3页
- 第4页
- 第5页
- 第6页
- 第7页
- 第8页
- 第9页
- 第10页
- 第11页
- 第12页
- 第13页
- 第14页
- 第15页
- 第16页
- 第17页
- 第18页
- 第19页
- 第20页
- 第21页
- 第22页
- 第23页
- 第24页
- 第25页
- 第26页
- 第27页
- 第28页
- 第29页
- 第30页
- 第31页
- 第32页
- 第33页
- 第34页
- 第35页
- 第36页
- 第37页
- 第38页
- 第39页
- 第40页
- 第41页
- 第42页
- 第43页
- 第44页
- 第45页
- 第46页
- 第47页
- 第48页
- 第49页
- 第50页
- 第51页
- 第52页
- 第53页
- 第54页
- 第55页
- 第56页
- 第57页
- 第58页
- 第59页
- 第60页
- 第61页
- 第62页
- 第63页
- 第64页
- 第65页
- 第66页
- 第67页
- 第68页
- 第69页
- 第70页
- 第71页
- 第72页
- 第73页
- 第74页
- 第75页
- 第76页
- 第77页
- 第78页
- 第79页
- 第80页
- 第81页
- 第82页
- 第83页
- 第84页
- 第85页
- 第86页
- 第87页
- 第88页
- 第89页
- 第90页
- 第91页
- 第92页
- 第93页
- 第94页
- 第95页
- 第96页
- 第97页
- 第98页
- 第99页
- 第100页
2. 原电池实验
按如图所示的装置实验,记录实验现象并解释原因。


按如图所示的装置实验,记录实验现象并解释原因。


答案:
溶解 不 无色气泡 偏转 失去 铜片表面 H⁺ 电子 H₂ 溶解 无色气泡 偏转 失去 石墨棒表面 H⁺ 电子 H₂ 不溶解 不偏转 H₂ 不能 没有
1. 根据以上实验,说明原电池的工作原理和构成要素。
______________________________
______________________________
答案:
(1)工作原理:负极失去电子发生氧化反应,电子通过导线流入正极,溶液中的离子在正极上得到电子发生还原反应。
(2)构成要素:①化学反应:自发进行的氧化还原反应。
②装置条件:a.活泼性不同的电极,b.电解质溶液,c.形成闭合回路。
(1)工作原理:负极失去电子发生氧化反应,电子通过导线流入正极,溶液中的离子在正极上得到电子发生还原反应。
(2)构成要素:①化学反应:自发进行的氧化还原反应。
②装置条件:a.活泼性不同的电极,b.电解质溶液,c.形成闭合回路。
2. 指出原电池实验中铜锌原电池的电极名称,并写出电极反应和电池总反应。
______________________________
______________________________
答案:
Zn:负极,Zn - 2e⁻ = Zn²⁺;
Cu:正极,2H⁺ + 2e⁻ = H₂↑;
电池总反应:Zn + 2H⁺ = Zn²⁺ + H₂↑。
Cu:正极,2H⁺ + 2e⁻ = H₂↑;
电池总反应:Zn + 2H⁺ = Zn²⁺ + H₂↑。
3. 在原电池实验中,若锌片、铜片接触,插入硫酸溶液,能否观察到电流?
______________________________
______________________________
答案:
不能。
4. 将原电池实验中锌—石墨原电池中的锌片换成铁片,能否形成电流?若能产生电流,写出电极反应和电池总反应。
______________________________
______________________________
答案:
能产生电流。
负极:Fe - 2e⁻ = Fe²⁺;
正极:2H⁺ + 2e⁻ = H₂↑;
电池总反应:Fe + 2H⁺ = Fe²⁺ + H₂↑。
负极:Fe - 2e⁻ = Fe²⁺;
正极:2H⁺ + 2e⁻ = H₂↑;
电池总反应:Fe + 2H⁺ = Fe²⁺ + H₂↑。
1. 某小组为研究原电池原理,设计了如图所示装置。下列叙述正确的是( )
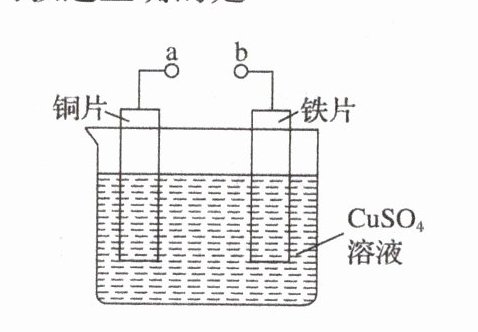
| |A.a和b不连接时,铁片上会有H₂产生|
| |B.a和b用导线连接时,铁片上发生的反应为Cu²⁺+2e⁻=Cu|
| |C.a和b用导线连接时,电子由a流向b|
| |D.无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色|

| |A.a和b不连接时,铁片上会有H₂产生|
| |B.a和b用导线连接时,铁片上发生的反应为Cu²⁺+2e⁻=Cu|
| |C.a和b用导线连接时,电子由a流向b|
| |D.无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色|
答案:
D
2. Ⅰ.现有两个反应:
a.NaOH+HCl=NaCl+H₂O
b.Cu+2Ag⁺=2Ag+Cu²⁺
(1)根据两反应本质,判断它们能否设计成原电池:______________________________。
如果不能,说明其原因:____________________。
(2)如果可以,则写出正、负极材料,电极反应式及反应类型(“氧化反应”或“还原反应”),电解质溶液名称。
负极:________,________________,______。
正极:________,________________,______。
电解质溶液:__________________________。
Ⅱ.常温下,将除去表面氧化膜的Al、Cu片插入浓HNO₃中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示。反应过程中有红棕色气体产生。
 |
|
O~t₁时,原电池的负极是Al片,此时,正极的电极反应式是____________________________,溶液中的H⁺向________移动;t₁时,原电池中电子流动方向发生改变,其原因是____________。
a.NaOH+HCl=NaCl+H₂O
b.Cu+2Ag⁺=2Ag+Cu²⁺
(1)根据两反应本质,判断它们能否设计成原电池:______________________________。
如果不能,说明其原因:____________________。
(2)如果可以,则写出正、负极材料,电极反应式及反应类型(“氧化反应”或“还原反应”),电解质溶液名称。
负极:________,________________,______。
正极:________,________________,______。
电解质溶液:__________________________。
Ⅱ.常温下,将除去表面氧化膜的Al、Cu片插入浓HNO₃中组成原电池(图1),测得原电池的电流强度(I)随时间(t)的变化如图2所示。反应过程中有红棕色气体产生。
 |
|O~t₁时,原电池的负极是Al片,此时,正极的电极反应式是____________________________,溶液中的H⁺向________移动;t₁时,原电池中电子流动方向发生改变,其原因是____________。
答案:
Ⅰ.
(1)a不能,b可以 a是非氧化还原反应,没有电子转移
(2)Cu Cu - 2e⁻ = Cu²⁺ 氧化反应 石墨棒(或Ag、铂、金等,任选一种) 2Ag⁺ + 2e⁻ = 2Ag 还原反应 硝酸银溶液
Ⅱ.2H⁺ + NO₃⁻ + e⁻ = NO₂↑ + H₂O 正极 Al在浓硝酸中发生钝化,形成的氧化膜阻止了Al进一步反应
解析 Ⅰ.
(1)能设计成原电池的化学反应必须是自发进行的氧化还原反应,否则不能设计成原电池。
(2)根据Cu + 2Ag⁺ = 2Ag + Cu²⁺可知,Cu应为负极,失电子被氧化,正极可为石墨棒、Ag等,正极上Ag⁺得电子生成Ag,电解质溶液为AgNO₃溶液。
Ⅱ.正极上NO₃⁻得电子发生还原反应,故电极反应式为2H⁺ + NO₃⁻ + e⁻ = NO₂↑ + H₂O;由图2可知t₁时刻电流方向改变,说明原电池的正、负极发生变化,Al因为在浓硝酸中发生钝化不再进一步反应,则t₁时刻后Cu片与浓HNO₃反应,Cu片作负极,Al片作正极。
(1)a不能,b可以 a是非氧化还原反应,没有电子转移
(2)Cu Cu - 2e⁻ = Cu²⁺ 氧化反应 石墨棒(或Ag、铂、金等,任选一种) 2Ag⁺ + 2e⁻ = 2Ag 还原反应 硝酸银溶液
Ⅱ.2H⁺ + NO₃⁻ + e⁻ = NO₂↑ + H₂O 正极 Al在浓硝酸中发生钝化,形成的氧化膜阻止了Al进一步反应
解析 Ⅰ.
(1)能设计成原电池的化学反应必须是自发进行的氧化还原反应,否则不能设计成原电池。
(2)根据Cu + 2Ag⁺ = 2Ag + Cu²⁺可知,Cu应为负极,失电子被氧化,正极可为石墨棒、Ag等,正极上Ag⁺得电子生成Ag,电解质溶液为AgNO₃溶液。
Ⅱ.正极上NO₃⁻得电子发生还原反应,故电极反应式为2H⁺ + NO₃⁻ + e⁻ = NO₂↑ + H₂O;由图2可知t₁时刻电流方向改变,说明原电池的正、负极发生变化,Al因为在浓硝酸中发生钝化不再进一步反应,则t₁时刻后Cu片与浓HNO₃反应,Cu片作负极,Al片作正极。
查看更多完整答案,请扫码查看


