1 [新情境] [2024长沙中考] 利用溶解度曲线可以获得许多有关物质溶解度的信息。甲、乙两种物质的溶解度曲线如图所示。下列说法正确的是( )
A. 在a₁℃时,甲和乙的溶解度均为30 g
B. 在a₂℃时,甲的溶解度小于乙的溶解度
C. 甲、乙两种物质的溶解度均随着温度的升高而减小
D. 升高温度,可将甲的不饱和溶液变为饱和溶液

A. 在a₁℃时,甲和乙的溶解度均为30 g
B. 在a₂℃时,甲的溶解度小于乙的溶解度
C. 甲、乙两种物质的溶解度均随着温度的升高而减小
D. 升高温度,可将甲的不饱和溶液变为饱和溶液

答案:
A

B(×):a₂℃时,甲的溶解度大于乙的溶解度
A(√):a₁℃时,甲和乙的溶解度相等,均为30 g
C(×):甲、乙两种物质的溶解度曲线都是上升型,因此甲、乙两种物质的溶解度都随着温度的升高而增大。D(×):升高温度,甲的溶解度增大,甲的不饱和溶液仍为不饱和溶液。
A

B(×):a₂℃时,甲的溶解度大于乙的溶解度
A(√):a₁℃时,甲和乙的溶解度相等,均为30 g
C(×):甲、乙两种物质的溶解度曲线都是上升型,因此甲、乙两种物质的溶解度都随着温度的升高而增大。D(×):升高温度,甲的溶解度增大,甲的不饱和溶液仍为不饱和溶液。
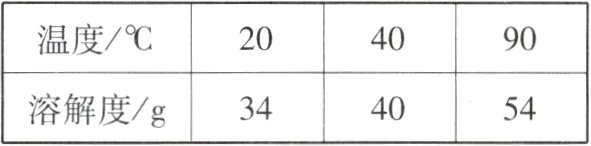
2 [2024宜宾中考] 为探究KCl固体在水中的溶解情况,进行下图所示的操作(忽略水的蒸发)。下列说法错误的是( )
A. ①的溶液中溶质的质量分数约为23%
B. ②的溶液为不饱和溶液
C. ②的溶液降温到20℃时会析出固体
D. ③的溶液质量是77 g

KCl在不同温度时的溶解度
A. ①的溶液中溶质的质量分数约为23%
B. ②的溶液为不饱和溶液
C. ②的溶液降温到20℃时会析出固体
D. ③的溶液质量是77 g

KCl在不同温度时的溶解度

答案:
B A(√):根据题表中数据可知,20℃时,KCl的溶解度为34 g,即100 g水中最多能溶解34 g KCl,则50 g水中最多能溶解17 g KCl,故15 g KCl加入50 g水中,固体全部溶解,此时溶液中溶质的质量分数为$\frac{15 g}{15 g + 50 g}$×100%≈23%。
B(×),C(√):40℃时,KCl的溶解度为40 g,即100 g水中最多能溶解40 g KCl,故50 g水中最多能溶解20 g KCl,②中加入KCl的质量为15 g + 5 g = 20 g,则此时②的溶液恰好饱和,降温到20℃时,KCl的溶解度减小,析出固体。D(√):90℃时,KCl的溶解度为54 g,即100 g水中最多能溶解54 g KCl,则50 g水中最多能溶解27 g KCl,③中加入KCl的质量为15 g + 5 g + 10 g = 30 g,最多溶解27 g,此时溶液的质量为27 g + 50 g = 77 g。
B(×),C(√):40℃时,KCl的溶解度为40 g,即100 g水中最多能溶解40 g KCl,故50 g水中最多能溶解20 g KCl,②中加入KCl的质量为15 g + 5 g = 20 g,则此时②的溶液恰好饱和,降温到20℃时,KCl的溶解度减小,析出固体。D(√):90℃时,KCl的溶解度为54 g,即100 g水中最多能溶解54 g KCl,则50 g水中最多能溶解27 g KCl,③中加入KCl的质量为15 g + 5 g + 10 g = 30 g,最多溶解27 g,此时溶液的质量为27 g + 50 g = 77 g。
3 [新情境] [2024湖南中考] 《天工开物·作咸》记载“候潮一过,明日天晴,半日晒出盐霜,疾趋扫起煎炼。”“盐霜”的主要成分是氯化钠固体,结合氯化钠溶解度曲线,回答下列问题:
(1) 20℃时,氯化钠的溶解度是______g。
(2) 氯化钠的溶解度随温度升高而______。
(3) “半日晒出盐霜”中的“晒”说明,从氯化钠溶液中得到晶体的方法是______结晶。

(1) 20℃时,氯化钠的溶解度是______g。
(2) 氯化钠的溶解度随温度升高而______。
(3) “半日晒出盐霜”中的“晒”说明,从氯化钠溶液中得到晶体的方法是______结晶。

答案:
(1)36.0
(2)增大
(3)蒸发
[解析] 分析氯化钠的溶解度曲线如下:

(3)“晒”的过程中溶剂蒸发、溶质结晶析出,该过程为蒸发结晶。
(1)36.0
(2)增大
(3)蒸发
[解析] 分析氯化钠的溶解度曲线如下:

(3)“晒”的过程中溶剂蒸发、溶质结晶析出,该过程为蒸发结晶。
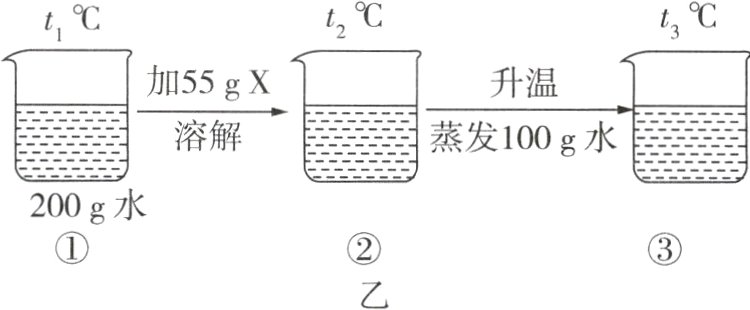
4 (1) 如图甲为KNO₃和NH₄Cl的溶解度曲线。

①溶解度随温度变化较大的物质是______。
②P点的含义是______。
③t₃℃时,将50 g KNO₃加入50 g水中充分溶解,得到的溶液是______(填“饱和溶液”或“不饱和溶液”),其溶质质量分数是____________(列式即可)。将该溶液降温至t₁℃,则在降温过程中,溶液中溶质的质量分数______(填“变大”“不变”或“变小”)。
④t₃℃时,等质量的KNO₃饱和溶液与NH₄Cl饱和溶液分别降温到t₂℃,析出晶体的质量为KNO₃______NH₄Cl(填“>”“<”或“=”)。从硝酸钾饱和溶液中获得硝酸钾晶体,采用______结晶法比较好。
(2) 已知X是KNO₃或NH₄Cl中的一种,据如图乙实验可知X是______,②和③中的溶液分别达到饱和状态还需加入X的质量更大的是______(填“②”或“③”)。

①溶解度随温度变化较大的物质是______。
②P点的含义是______。
③t₃℃时,将50 g KNO₃加入50 g水中充分溶解,得到的溶液是______(填“饱和溶液”或“不饱和溶液”),其溶质质量分数是____________(列式即可)。将该溶液降温至t₁℃,则在降温过程中,溶液中溶质的质量分数______(填“变大”“不变”或“变小”)。
④t₃℃时,等质量的KNO₃饱和溶液与NH₄Cl饱和溶液分别降温到t₂℃,析出晶体的质量为KNO₃______NH₄Cl(填“>”“<”或“=”)。从硝酸钾饱和溶液中获得硝酸钾晶体,采用______结晶法比较好。
(2) 已知X是KNO₃或NH₄Cl中的一种,据如图乙实验可知X是______,②和③中的溶液分别达到饱和状态还需加入X的质量更大的是______(填“②”或“③”)。

答案:
(1)①硝酸钾(或KNO₃) ②t₂℃时,硝酸钾和氯化铵的溶解度相等,均为42 g ③饱和溶液 $\frac{40 g}{40 g + 50 g}$×100% 变小 ④> 降温
(2)硝酸钾 ②
[解析]
(1)由图甲可知,溶解度随着温度变化较大的物质是硝酸钾。②P点是两物质溶解度曲线的交点,表示t₂℃时,硝酸钾和氯化铵的溶解度相等,均为42 g。③t₃℃时,KNO₃的溶解度为80 g,将50 g KNO₃加入50 g水中充分溶解,只能溶解40 g,得到的溶液是饱和溶液,其溶质质量分数是$\frac{40 g}{40 g + 50 g}$×100%。将该溶液降温至t₁℃,析出固体,溶质质量减小,溶剂质量不变,则在降温过程中,溶液中溶质的质量分数变小。④t₃℃时,等质量的KNO₃饱和溶液与NH₄Cl饱和溶液分别降温到t₂℃,硝酸钾的溶解度变化程度更大,所以析出晶体的质量为KNO₃>NH₄Cl。硝酸钾的溶解度随着温度的升高而显著增大,所以从硝酸钾饱和溶液中获得硝酸钾晶体,采用降温结晶法比较好。
(2)根据图乙,③烧杯中含有100 g水、55 g X,根据溶解度曲线,t₃℃时氯化铵的溶解度为50 g,硝酸钾的溶解度为80 g,则100 g水中最多能溶解氯化铵的质量为50 g,最多能溶解硝酸钾的质量为80 g,故X应为硝酸钾。t₂℃时硝酸钾的溶解度为42 g,200 g水中最多能溶解84 g硝酸钾,则要达到饱和还需要溶解硝酸钾的质量为84 g - 55 g = 29 g;t₃℃时硝酸钾的溶解度为80 g,则要达到饱和还需要溶解硝酸钾的质量为80 g - 55 g = 25 g;故还需加入X的质量更大的是②。
(1)①硝酸钾(或KNO₃) ②t₂℃时,硝酸钾和氯化铵的溶解度相等,均为42 g ③饱和溶液 $\frac{40 g}{40 g + 50 g}$×100% 变小 ④> 降温
(2)硝酸钾 ②
[解析]
(1)由图甲可知,溶解度随着温度变化较大的物质是硝酸钾。②P点是两物质溶解度曲线的交点,表示t₂℃时,硝酸钾和氯化铵的溶解度相等,均为42 g。③t₃℃时,KNO₃的溶解度为80 g,将50 g KNO₃加入50 g水中充分溶解,只能溶解40 g,得到的溶液是饱和溶液,其溶质质量分数是$\frac{40 g}{40 g + 50 g}$×100%。将该溶液降温至t₁℃,析出固体,溶质质量减小,溶剂质量不变,则在降温过程中,溶液中溶质的质量分数变小。④t₃℃时,等质量的KNO₃饱和溶液与NH₄Cl饱和溶液分别降温到t₂℃,硝酸钾的溶解度变化程度更大,所以析出晶体的质量为KNO₃>NH₄Cl。硝酸钾的溶解度随着温度的升高而显著增大,所以从硝酸钾饱和溶液中获得硝酸钾晶体,采用降温结晶法比较好。
(2)根据图乙,③烧杯中含有100 g水、55 g X,根据溶解度曲线,t₃℃时氯化铵的溶解度为50 g,硝酸钾的溶解度为80 g,则100 g水中最多能溶解氯化铵的质量为50 g,最多能溶解硝酸钾的质量为80 g,故X应为硝酸钾。t₂℃时硝酸钾的溶解度为42 g,200 g水中最多能溶解84 g硝酸钾,则要达到饱和还需要溶解硝酸钾的质量为84 g - 55 g = 29 g;t₃℃时硝酸钾的溶解度为80 g,则要达到饱和还需要溶解硝酸钾的质量为80 g - 55 g = 25 g;故还需加入X的质量更大的是②。
查看更多完整答案,请扫码查看


