1 [2023重庆中考B卷改编]某小组用NaCl固体配制50g溶质质量分数为6%的NaCl溶液,下列说法正确的是 ( )
A. 玻璃棒的作用只有引流
B. NaCl固体中含有杂质,溶质质量分数变小
C. 实验中会用到蒸发皿
D. 用蒸馏水洗涤烧杯后,立即溶解氯化钠
A. 玻璃棒的作用只有引流
B. NaCl固体中含有杂质,溶质质量分数变小
C. 实验中会用到蒸发皿
D. 用蒸馏水洗涤烧杯后,立即溶解氯化钠
答案:
B A(×):溶解氯化钠时需用玻璃棒搅拌,是为了加快溶解。B(√):NaCl固体中混有杂质,会造成溶质的质量偏小,导致溶质质量分数变小。C(×):配制过程中,称量氯化钠需要用到托盘天平和药匙,量取水需要用到量筒和胶头滴管,溶解需要用到烧杯和玻璃棒,存放需要用到细口瓶,实验中不会用到蒸发皿。D(×):用蒸馏水洗涤烧杯后,立即溶解氯化钠,烧杯中有水,会使配制的溶液的溶质质量分数偏小。
2 [2024河南中考]某同学在实验室配制一定溶质质量分数的氯化钠溶液,若其他操作均正确,量取水时俯视量筒读数,会导致所配制溶液的质量分数 ( )
A. 偏大
B. 偏小
C. 不变
D. 无法判断
A. 偏大
B. 偏小
C. 不变
D. 无法判断
答案:
A 俯视读数时,所取液体体积偏小,导致所配溶液的质量分数偏大。
技巧点拨
量筒读数误差分析

量筒俯视仰视口诀:
(1)使用量筒读数时(液体体积未知)俯大仰小;
(2)量取一定体积的液体时(液体体积已知)仰多俯少。
A 俯视读数时,所取液体体积偏小,导致所配溶液的质量分数偏大。
技巧点拨
量筒读数误差分析

量筒俯视仰视口诀:
(1)使用量筒读数时(液体体积未知)俯大仰小;
(2)量取一定体积的液体时(液体体积已知)仰多俯少。
3 [2024漯河一模]实验室用氯化钠配制250g生理盐水(溶质质量分数为0.9%的氯化钠溶液),下列有关叙述不正确的是 ( )
A. 实验步骤:计算、称量、量取、溶解、装瓶贴标签
B. 称量时,将氯化钠固体放在天平的左盘称量
C. 量取蒸馏水时需要用到量筒和胶头滴管
D. 溶解时用玻璃棒搅拌,以增大氯化钠的溶解度
A. 实验步骤:计算、称量、量取、溶解、装瓶贴标签
B. 称量时,将氯化钠固体放在天平的左盘称量
C. 量取蒸馏水时需要用到量筒和胶头滴管
D. 溶解时用玻璃棒搅拌,以增大氯化钠的溶解度
答案:
D A(√):实验室用氯化钠配制氯化钠溶液的步骤应为计算、称量、量取、溶解、装瓶贴标签,不符合题意。B(√):托盘天平的使用要遵循“左物右码”的原则,称量时,应将氯化钠固体放在天平的左盘,不符合题意。C(√):量取蒸馏水时需要用到量筒和胶头滴管,不符合题意。D(×):溶解时用玻璃棒搅拌,作用是加速溶解,不能改变氯化钠的溶解度。
4 [2024重庆九龙坡模拟]农业上常用溶质质量分数为16%的NaCl溶液选种。实验室配制100g该浓度溶液的过程如下图所示。下列说法错误的是 ( )
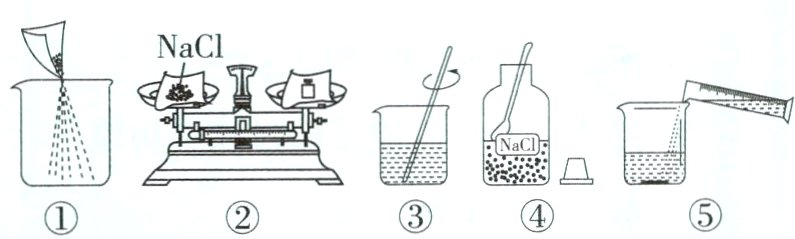
A. 实验操作顺序为④②①⑤③
B. ②中需称量NaCl的质量为16.0g
C. 选用100mL量筒量取所需水
D. ①中有固体洒落,对配制的溶液浓度无影响

A. 实验操作顺序为④②①⑤③
B. ②中需称量NaCl的质量为16.0g
C. 选用100mL量筒量取所需水
D. ①中有固体洒落,对配制的溶液浓度无影响
答案:
D A(√):用固体溶质配制一定质量分数的溶液的步骤为:计算、称量、溶解、装瓶贴标签,故操作顺序为④②①⑤③,不符合题意。B(√):实验室配制100 g溶质质量分数为16%的氯化钠溶液,则②中需称量NaCl的质量为100 g×16% = 16.0 g,不符合题意。C(√):根据B中的计算,可得需要加入水的质量为100 g - 16 g = 84 g,则需要量取水的体积为84 mL,应选用100 mL量筒量取,不符合题意。D(×):题图①中有部分固体洒落,导致溶解的氯化钠的质量偏小,会造成所配溶液的浓度偏小,符合题意。
5 [2023抚顺中考改编]用溶质质量分数为98%的浓硫酸配制100g溶质质量分数为10%的硫酸。下列说法正确的是 ( )
A. 需要98%的浓硫酸的质量为10g,水的质量为90g
B. 用量筒量取浓硫酸时仰视读数,会导致配制的溶液溶质质量分数偏大
C. 混匀时应将浓硫酸注入盛有水的量筒中,并用玻璃棒不断搅拌
D. 装瓶时有少量液体溅出,会导致配制的溶液溶质质量分数偏小
A. 需要98%的浓硫酸的质量为10g,水的质量为90g
B. 用量筒量取浓硫酸时仰视读数,会导致配制的溶液溶质质量分数偏大
C. 混匀时应将浓硫酸注入盛有水的量筒中,并用玻璃棒不断搅拌
D. 装瓶时有少量液体溅出,会导致配制的溶液溶质质量分数偏小
答案:
B A(×):根据溶液稀释前后溶质质量不变,得出需要98%的浓硫酸的质量是$\frac{100g×10\%}{98\%}\approx10.2g$,则需要水的质量是100 g - 10.2 g = 89.8 g。B(√):用量筒量取浓硫酸时,仰视读数会使量取的浓硫酸的体积偏大(溶质质量偏大),导致配制的溶液的溶质质量分数偏大。C(×):不能在量筒中稀释溶液,应在烧杯中进行。D(×):装瓶时有少量液体溅出,溶液具有均一性和稳定性,不会导致配制的溶液的溶质质量分数发生改变。
6 某实验小组用6%的氯化钠溶液(密度约为1.04g/cm³)配制50g溶质质量分数为3%的氯化钠溶液,步骤如下:①计算;②量取;③混匀;④装瓶贴标签。回答下列问题:
(1)计算需要6%的氯化钠溶液的体积是________(结果取整数)mL。
(2)实验中用到的仪器有25mL的量筒、细口瓶、烧杯、____________________。
(3)下列实验操作会导致所配溶液的溶质质量分数一定偏大的是________(填字母)。
A. 量取6%的氯化钠溶液时俯视读数
B. 向烧杯内加入水时有水洒出
C. 混匀过程中没有使用玻璃棒搅拌
D. 配制好的溶液装入未干燥的细口瓶
(1)计算需要6%的氯化钠溶液的体积是________(结果取整数)mL。
(2)实验中用到的仪器有25mL的量筒、细口瓶、烧杯、____________________。
(3)下列实验操作会导致所配溶液的溶质质量分数一定偏大的是________(填字母)。
A. 量取6%的氯化钠溶液时俯视读数
B. 向烧杯内加入水时有水洒出
C. 混匀过程中没有使用玻璃棒搅拌
D. 配制好的溶液装入未干燥的细口瓶
答案:
(1)24
(2)胶头滴管、玻璃棒
(3)B
【解析】
(1)溶液稀释过程中溶质的质量保持不变,设配制50 g 3%的氯化钠溶液需要6%的氯化钠溶液的质量为x,有6%×x = 50 g×3%,解得x = 25 g,需要6%的氯化钠溶液的体积为$\frac{25g}{1.04g/cm^{3}}\approx24cm^{3}=24mL$。
(2)实验中用到的仪器有25 mL的量筒、细口瓶、烧杯、胶头滴管、玻璃棒。
(3)A(×):量取6%的氯化钠溶液时俯视读数,会使实际量取的液体体积比读数小,导致溶质质量分数偏小。B(√):向烧杯内加入水时有水洒出,会使水的体积偏小,导致溶质质量分数偏大。C(×):混匀过程中没有使用玻璃棒搅拌,不会导致溶剂和溶质质量的变化,溶质质量分数不变。D(×):配制好的溶液装入未干燥的细口瓶,相当于稀释了溶液,导致溶质质量分数偏小。
(1)24
(2)胶头滴管、玻璃棒
(3)B
【解析】
(1)溶液稀释过程中溶质的质量保持不变,设配制50 g 3%的氯化钠溶液需要6%的氯化钠溶液的质量为x,有6%×x = 50 g×3%,解得x = 25 g,需要6%的氯化钠溶液的体积为$\frac{25g}{1.04g/cm^{3}}\approx24cm^{3}=24mL$。
(2)实验中用到的仪器有25 mL的量筒、细口瓶、烧杯、胶头滴管、玻璃棒。
(3)A(×):量取6%的氯化钠溶液时俯视读数,会使实际量取的液体体积比读数小,导致溶质质量分数偏小。B(√):向烧杯内加入水时有水洒出,会使水的体积偏小,导致溶质质量分数偏大。C(×):混匀过程中没有使用玻璃棒搅拌,不会导致溶剂和溶质质量的变化,溶质质量分数不变。D(×):配制好的溶液装入未干燥的细口瓶,相当于稀释了溶液,导致溶质质量分数偏小。
查看更多完整答案,请扫码查看


