1 [2023怀化中考]下列各组物质在同一溶液中能大量共存,且溶液为无色的是( )
A. NaCl、$BaCl_{2}$、HCl
B. $CuCl_{2}$、KCl、$H_{2}SO_{4}$
C. $Ca(NO_{3})_{2}$、$Na_{2}CO_{3}$、KOH
D. HCl、NaOH、$Na_{2}SO_{4}$
A. NaCl、$BaCl_{2}$、HCl
B. $CuCl_{2}$、KCl、$H_{2}SO_{4}$
C. $Ca(NO_{3})_{2}$、$Na_{2}CO_{3}$、KOH
D. HCl、NaOH、$Na_{2}SO_{4}$
答案:
A A(√):三种物质两两之间相互交换成分不会产生沉淀、气体或水,即相互之间不会发生反应,可以在同一溶液中大量共存,且溶液为无色。B(×):氯化铜在溶液中呈蓝色。C(×):Ca(NO₃)₂和Na₂CO₃会反应生成碳酸钙沉淀和硝酸钠,不能在同一溶液中大量共存。D(×):HCl和NaOH反应生成水和氯化钠,不能在同一溶液中大量共存。
2 [教材习题改编][2022河北中考改编]向含有酚酞溶液的氢氧化钠溶液中慢慢滴入稀硫酸,该过程中溶液pH的变化如图所示。下列分析正确的是( )
A. N点时的溶液一定呈红色
B. P点时的溶液能与碳酸钙发生反应

C. M→N过程中溶液的碱性逐渐增强
D. M→P过程中生成的硫酸钠不断增加
A. N点时的溶液一定呈红色
B. P点时的溶液能与碳酸钙发生反应

C. M→N过程中溶液的碱性逐渐增强
D. M→P过程中生成的硫酸钠不断增加
答案:
B 氢氧化钠溶液显碱性,pH > 7,能使酚酞溶液变红,随着稀硫酸的滴入,氢氧化钠与稀硫酸反应生成硫酸钠和水,二者恰好完全反应时,所得溶液为硫酸钠溶液,溶液显中性,pH = 7,继续加入稀硫酸,溶液为硫酸钠、硫酸的混合溶液,显酸性,pH < 7。A(×):据此分析图像信息,可知N点时溶液的pH = 7,呈中性,不能使酚酞溶液变红,此时溶液为无色。B(√):P点时溶液的pH < 7,显酸性,溶液为硫酸钠、硫酸的混合溶液,其中所含的硫酸能与碳酸钙发生反应生成硫酸钙、水和二氧化碳。C(×):M→N的过程中,溶液的pH由大于7逐渐减小至等于7,碱性逐渐减弱至恰好变为中性。D(×):N点时氢氧化钠与稀硫酸恰好完全反应,N→P的过程中稀硫酸过量,反应不再发生,硫酸钠的质量在N点后保持不变。
3 [2024山西中考]室温下,向一定体积10%的氢氧化钠溶液中滴加10%的盐酸,测得溶液温度变化与加入盐酸体积的关系如表($\Delta t$为溶液实时温度与初始温度差),其中表述正确的是( )
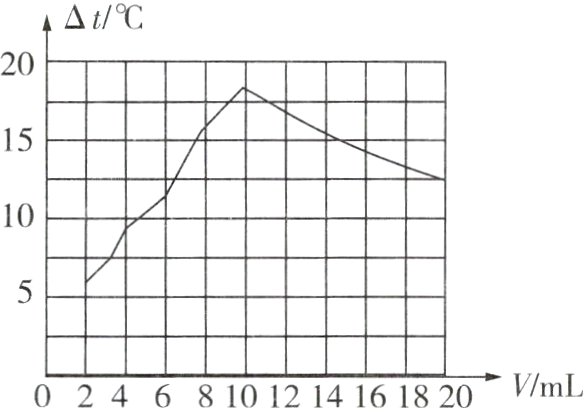

A. 滴加盐酸的全过程中,持续发生反应并放出热量
B. 滴加盐酸的过程中,溶液的碱性逐渐增强
C. 滴加盐酸的全过程中,氯化钠的溶解度逐渐增大
D. 反应过程中,氢氧化钠在混合溶液中的浓度逐渐减小


A. 滴加盐酸的全过程中,持续发生反应并放出热量
B. 滴加盐酸的过程中,溶液的碱性逐渐增强
C. 滴加盐酸的全过程中,氯化钠的溶解度逐渐增大
D. 反应过程中,氢氧化钠在混合溶液中的浓度逐渐减小
答案:
D

A(×):当加入盐酸的量大于10 mL,小于20 mL时,盐酸过量,溶液的温度逐渐下降,且没有发生化学反应。B(×):盐酸和氢氧化钠反应生成氯化钠和水,滴加盐酸的过程中,氢氧化钠不断被消耗,溶液的碱性逐渐减弱。C(×):盐酸和氢氧化钠反应过程中放出热量,溶液的温度升高,氯化钠的溶解度增大;当氢氧化钠完全反应后,溶液温度下降,氯化钠的溶解度减小。D(√):盐酸和氢氧化钠反应生成氯化钠和水,反应过程中,氢氧化钠不断被消耗,氢氧化钠在混合溶液中的浓度逐渐减小。
D

A(×):当加入盐酸的量大于10 mL,小于20 mL时,盐酸过量,溶液的温度逐渐下降,且没有发生化学反应。B(×):盐酸和氢氧化钠反应生成氯化钠和水,滴加盐酸的过程中,氢氧化钠不断被消耗,溶液的碱性逐渐减弱。C(×):盐酸和氢氧化钠反应过程中放出热量,溶液的温度升高,氯化钠的溶解度增大;当氢氧化钠完全反应后,溶液温度下降,氯化钠的溶解度减小。D(√):盐酸和氢氧化钠反应生成氯化钠和水,反应过程中,氢氧化钠不断被消耗,氢氧化钠在混合溶液中的浓度逐渐减小。
4 [创新实验][2023北京中考]用如图装置进行实验。

(1)将无色酚酞溶液滴入a中,溶液颜色变为________;再将浓盐酸滴入b中,一段时间后,a中溶液褪色,说明$Ca(OH)_{2}$与HCl发生了反应,化学方程式为________________________。
(2)该实验说明浓盐酸的性质有酸性和________。

(1)将无色酚酞溶液滴入a中,溶液颜色变为________;再将浓盐酸滴入b中,一段时间后,a中溶液褪色,说明$Ca(OH)_{2}$与HCl发生了反应,化学方程式为________________________。
(2)该实验说明浓盐酸的性质有酸性和________。
答案:
(1)红色 Ca(OH)₂ + 2HCl $\xlongequal{}$ CaCl₂ + 2H₂O
(2)挥发性
【解析】
(1)a中装有澄清石灰水,将无色酚酞溶液滴入澄清石灰水中,溶液颜色变为红色;再将浓盐酸滴入b中,一段时间后,a中溶液褪色,说明Ca(OH)₂与HCl发生了反应生成氯化钙和水,化学方程式为Ca(OH)₂ + 2HCl $\xlongequal{}$ CaCl₂ + 2H₂O。
(2)浓盐酸易挥发,挥发出的氯化氢进入a中,与氢氧化钙反应生成氯化钙和水,该实验说明浓盐酸有酸性和挥发性。
(1)红色 Ca(OH)₂ + 2HCl $\xlongequal{}$ CaCl₂ + 2H₂O
(2)挥发性
【解析】
(1)a中装有澄清石灰水,将无色酚酞溶液滴入澄清石灰水中,溶液颜色变为红色;再将浓盐酸滴入b中,一段时间后,a中溶液褪色,说明Ca(OH)₂与HCl发生了反应生成氯化钙和水,化学方程式为Ca(OH)₂ + 2HCl $\xlongequal{}$ CaCl₂ + 2H₂O。
(2)浓盐酸易挥发,挥发出的氯化氢进入a中,与氢氧化钙反应生成氯化钙和水,该实验说明浓盐酸有酸性和挥发性。
5 [创新实验][2024烟台中考]某兴趣小组借助数字技术探究“稀盐酸与氢氧化钠溶液反应”,图1所示是室温下稀盐酸与氢氧化钠溶液反应的实验装置,图2是反应过程中的pH变化曲线。


(1)根据图2曲线判断,图1中的溶液B是________。
(2)图2中a点所示的溶液pH________7(填“>”“<”或“=”),溶液呈现________(填“酸性”“碱性”或“中性”)。
(3)c点所示的溶液中$Na^{+}$个数与$Cl^{-}$个数关系是:$N(Na^{+})$________$N(Cl^{-})$(填“>”“<”或“=”)。
(4)a点到b点pH变化的微观本质是______________________________。


(1)根据图2曲线判断,图1中的溶液B是________。
(2)图2中a点所示的溶液pH________7(填“>”“<”或“=”),溶液呈现________(填“酸性”“碱性”或“中性”)。
(3)c点所示的溶液中$Na^{+}$个数与$Cl^{-}$个数关系是:$N(Na^{+})$________$N(Cl^{-})$(填“>”“<”或“=”)。
(4)a点到b点pH变化的微观本质是______________________________。
答案:
(1)稀盐酸
(2) > 碱性
(3) <
(4)氢氧根离子与氢离子结合成水分子
【解析】
(1)分析题图2,最初溶液的pH > 7,呈现碱性,说明题图1中溶液A为氢氧化钠溶液,该实验是将稀盐酸滴入氢氧化钠溶液中,溶液B是稀盐酸。
(2)题图2中a点所示溶液pH > 7,溶液呈现碱性。
(3)c点所示溶液的pH < 7,溶液呈现酸性,此时稀盐酸过量,溶液中溶质为氯化钠、氯化氢,其中钠离子个数小于氯离子个数。
(4)a点到b点反应的实质是氢氧根离子与氢离子结合成水分子。

(1)稀盐酸
(2) > 碱性
(3) <
(4)氢氧根离子与氢离子结合成水分子
【解析】
(1)分析题图2,最初溶液的pH > 7,呈现碱性,说明题图1中溶液A为氢氧化钠溶液,该实验是将稀盐酸滴入氢氧化钠溶液中,溶液B是稀盐酸。
(2)题图2中a点所示溶液pH > 7,溶液呈现碱性。
(3)c点所示溶液的pH < 7,溶液呈现酸性,此时稀盐酸过量,溶液中溶质为氯化钠、氯化氢,其中钠离子个数小于氯离子个数。
(4)a点到b点反应的实质是氢氧根离子与氢离子结合成水分子。

查看更多完整答案,请扫码查看


