1 [创新实验 [2024安徽三模] 如图是探究氢氧化钠与二氧化碳能否发生化学反应的创新实验装置。步骤①:夹紧止水夹,将注射器中的氢氧化钠溶液全部迅速注入充满二氧化碳的甲瓶中。步骤②:一段时间后,打开止水夹,观察现象。下列关于该实验的说法不正确的是 ( )
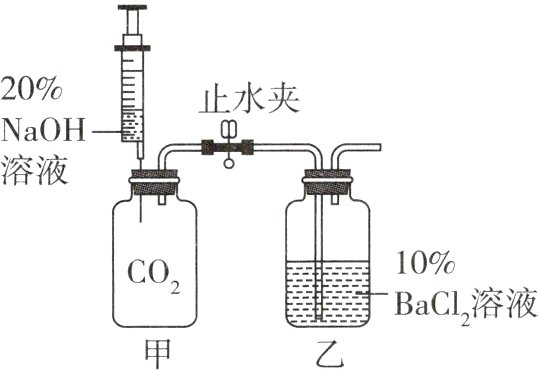
A. 氢氧化钠溶液全部迅速注入甲瓶后,注射器活塞微微向上移动,说明甲瓶内压强瞬间增大
B. 步骤①中发生的反应属于复分解反应
C. 步骤②中打开止水夹后,BaCl₂溶液进入甲瓶中,甲瓶内产生沉淀
D. 该实验能说明氢氧化钠与二氧化碳发生了反应

A. 氢氧化钠溶液全部迅速注入甲瓶后,注射器活塞微微向上移动,说明甲瓶内压强瞬间增大
B. 步骤①中发生的反应属于复分解反应
C. 步骤②中打开止水夹后,BaCl₂溶液进入甲瓶中,甲瓶内产生沉淀
D. 该实验能说明氢氧化钠与二氧化碳发生了反应
答案:
过专项阶段强化专项训练
1 B A(√):氢氧化钠溶液全部迅速注入甲瓶后,挤压甲瓶中的二氧化碳,压强瞬间增大,注射器活塞向上移动。B(×):步骤①中氢氧化钠与二氧化碳反应生成碳酸钠和水,虽然是两种化合物生成另外两种化合物的反应,但没有相互交换成分,不属于复分解反应。C(√):步骤②中打开止水夹后,BaCl₂溶液进入甲瓶中,碳酸钠和氯化钡生成了碳酸钡白色沉淀。D(√):打开止水夹后,BaCl₂溶液进入甲瓶中,甲瓶内产生沉淀,说明有碳酸钡生成,所以氢氧化钠与二氧化碳发生了反应,生成了碳酸钠。
1 B A(√):氢氧化钠溶液全部迅速注入甲瓶后,挤压甲瓶中的二氧化碳,压强瞬间增大,注射器活塞向上移动。B(×):步骤①中氢氧化钠与二氧化碳反应生成碳酸钠和水,虽然是两种化合物生成另外两种化合物的反应,但没有相互交换成分,不属于复分解反应。C(√):步骤②中打开止水夹后,BaCl₂溶液进入甲瓶中,碳酸钠和氯化钡生成了碳酸钡白色沉淀。D(√):打开止水夹后,BaCl₂溶液进入甲瓶中,甲瓶内产生沉淀,说明有碳酸钡生成,所以氢氧化钠与二氧化碳发生了反应,生成了碳酸钠。
2 [2024辽宁中考] 为实现氢氧化钠溶液和盐酸反应现象的可视化,某兴趣小组设计如下实验。
【监测温度】(1) 在稀氢氧化钠溶液和稀盐酸反应过程中,温度传感器监测到溶液温度升高,说明该反应______(填“吸热”或“放热”),化学方程式为________________________。
【观察颜色】(2) 在试管中加入2mL某浓度的氢氧化钠溶液,滴入2滴酚酞溶液作______剂,再逐滴加入盐酸,振荡,该过程中溶液的颜色和pH记录如下图所示。

(3) 在①中未观察到预期的红色,为探明原因,小组同学查阅到酚酞变色范围如下:0 < pH < 8.2时呈无色,8.2 < pH < 13时呈红色,pH > 13时呈无色。据此推断,①中a的取值范围是________。
A. 0 < a < 8.2 B. 8.2 < a < 13 C. a > 13
(4) 一段时间后,重复(2)实验,观察到滴加盐酸的过程中有少量气泡生成,原因是________________________。
【观察沉淀】(5) 小组同学提出,可通过调控反应物浓度观察生成的氯化钠沉淀。向含8g溶质的浓氢氧化钠溶液中加入浓盐酸,恰好完全反应至中性,生成NaCl的质量为________g;恢复至室温,称得混合物的总质量为36.7g,其中NaCl沉淀的质量为________g。(提示:室温下100g水最多能溶解36gNaCl。)
【多现象可视】[创新实验 (6) 如下图所示,注射器1、3中均为8mL氯化氢气体,注射器2、4中分别为2mL蒸馏水和稀氢氧化钠溶液(均滴有酚酞溶液)。打开弹簧夹,迅速将注射器1、3中全部氯化氢分别推入注射器2、4中,用弹簧夹夹紧胶皮管。最终发现注射器2、4的活塞均恢复至2mL刻度附近,此现象不足以说明氯化氢与稀氢氧化钠溶液发生了反应,理由是______________________________。若实验中溶液始终澄清,为了说明中和反应已发生,还应依据的现象为______________________________。

【监测温度】(1) 在稀氢氧化钠溶液和稀盐酸反应过程中,温度传感器监测到溶液温度升高,说明该反应______(填“吸热”或“放热”),化学方程式为________________________。
【观察颜色】(2) 在试管中加入2mL某浓度的氢氧化钠溶液,滴入2滴酚酞溶液作______剂,再逐滴加入盐酸,振荡,该过程中溶液的颜色和pH记录如下图所示。

(3) 在①中未观察到预期的红色,为探明原因,小组同学查阅到酚酞变色范围如下:0 < pH < 8.2时呈无色,8.2 < pH < 13时呈红色,pH > 13时呈无色。据此推断,①中a的取值范围是________。
A. 0 < a < 8.2 B. 8.2 < a < 13 C. a > 13
(4) 一段时间后,重复(2)实验,观察到滴加盐酸的过程中有少量气泡生成,原因是________________________。
【观察沉淀】(5) 小组同学提出,可通过调控反应物浓度观察生成的氯化钠沉淀。向含8g溶质的浓氢氧化钠溶液中加入浓盐酸,恰好完全反应至中性,生成NaCl的质量为________g;恢复至室温,称得混合物的总质量为36.7g,其中NaCl沉淀的质量为________g。(提示:室温下100g水最多能溶解36gNaCl。)
【多现象可视】[创新实验 (6) 如下图所示,注射器1、3中均为8mL氯化氢气体,注射器2、4中分别为2mL蒸馏水和稀氢氧化钠溶液(均滴有酚酞溶液)。打开弹簧夹,迅速将注射器1、3中全部氯化氢分别推入注射器2、4中,用弹簧夹夹紧胶皮管。最终发现注射器2、4的活塞均恢复至2mL刻度附近,此现象不足以说明氯化氢与稀氢氧化钠溶液发生了反应,理由是______________________________。若实验中溶液始终澄清,为了说明中和反应已发生,还应依据的现象为______________________________。

答案:
(1)放热 HCl + NaOH = NaCl + H₂O
(2)指示
(3)C
(4)氢氧化钠变质(或盐酸与碳酸钠发生反应)
(5)11.7 2.7
(6)氯化氢溶于水也可导致注射器4的活塞恢复至2mL刻度附近(或注射器2中没有发生酸碱中和反应,且注射器2、4的活塞均恢复至2mL刻度附近) 注射器2中溶液仍为无色,注射器4中溶液由红色变为无色(或反应后注射器4比注射器2温度高)
[解析]
(1)在稀氢氧化钠溶液和稀盐酸反应过程中,温度传感器监测到溶液温度升高,说明该反应是放热反应。氢氧化钠和稀盐酸反应生成氯化钠和水,反应的化学方程式是HCl + NaOH = NaCl + H₂O。
(3)结合图示和酚酞变色范围,可知a的取值范围应大于13。
(4)一段时间后,重复向氢氧化钠溶液中加入稀盐酸有气泡产生,产生的气体应该是盐酸和氢氧化钠变质产生的碳酸钠反应产生的二氧化碳。
(5)解:设向含8g溶质的浓氢氧化钠溶液中加入浓盐酸,恰好完全反应至中性,生成NaCl的质量为x,
HCl + NaOH = NaCl + H₂O
40 58.5
8g x
$\frac{40}{58.5}=\frac{8g}{x}$
x = 11.7g
恢复至室温,称得混合物的总质量为36.7g,其中NaCl的质量为11.7g,所以,水的质量 = 36.7g - 11.7g = 25g,根据提示:
室温下100g水最多能溶解36gNaCl,可计算出25g水最多能溶解9gNaCl,所以氯化钠沉淀的质量为11.7g - 9g = 2.7g。
(6)此实验利用控制变量法做的对比实验,注射器2中没有发生酸碱中和反应,只是氯化氢溶于水,且注射器2、4的活塞均恢复至2mL刻度附近,依据此现象不足以说明注射器4中氯化氢与稀氢氧化钠溶液发生反应。为了说明中和反应已发生,可以通过注射器2和4中溶液颜色的变化来说明,注射器2中未发生反应,溶液依然为无色,注射器4中发生反应氢氧化钠消失,溶液不再是碱性,所以溶液的红色会消失;或依据中和反应放热,通过观察注射器2和4中温度的变化来说明中和反应已发生。
(1)放热 HCl + NaOH = NaCl + H₂O
(2)指示
(3)C
(4)氢氧化钠变质(或盐酸与碳酸钠发生反应)
(5)11.7 2.7
(6)氯化氢溶于水也可导致注射器4的活塞恢复至2mL刻度附近(或注射器2中没有发生酸碱中和反应,且注射器2、4的活塞均恢复至2mL刻度附近) 注射器2中溶液仍为无色,注射器4中溶液由红色变为无色(或反应后注射器4比注射器2温度高)
[解析]
(1)在稀氢氧化钠溶液和稀盐酸反应过程中,温度传感器监测到溶液温度升高,说明该反应是放热反应。氢氧化钠和稀盐酸反应生成氯化钠和水,反应的化学方程式是HCl + NaOH = NaCl + H₂O。
(3)结合图示和酚酞变色范围,可知a的取值范围应大于13。
(4)一段时间后,重复向氢氧化钠溶液中加入稀盐酸有气泡产生,产生的气体应该是盐酸和氢氧化钠变质产生的碳酸钠反应产生的二氧化碳。
(5)解:设向含8g溶质的浓氢氧化钠溶液中加入浓盐酸,恰好完全反应至中性,生成NaCl的质量为x,
HCl + NaOH = NaCl + H₂O
40 58.5
8g x
$\frac{40}{58.5}=\frac{8g}{x}$
x = 11.7g
恢复至室温,称得混合物的总质量为36.7g,其中NaCl的质量为11.7g,所以,水的质量 = 36.7g - 11.7g = 25g,根据提示:
室温下100g水最多能溶解36gNaCl,可计算出25g水最多能溶解9gNaCl,所以氯化钠沉淀的质量为11.7g - 9g = 2.7g。
(6)此实验利用控制变量法做的对比实验,注射器2中没有发生酸碱中和反应,只是氯化氢溶于水,且注射器2、4的活塞均恢复至2mL刻度附近,依据此现象不足以说明注射器4中氯化氢与稀氢氧化钠溶液发生反应。为了说明中和反应已发生,可以通过注射器2和4中溶液颜色的变化来说明,注射器2中未发生反应,溶液依然为无色,注射器4中发生反应氢氧化钠消失,溶液不再是碱性,所以溶液的红色会消失;或依据中和反应放热,通过观察注射器2和4中温度的变化来说明中和反应已发生。
查看更多完整答案,请扫码查看


