1 [2024南通中考]诗句“千锤万凿出深山,烈火焚烧若等闲”中涉及的石灰石,其主要成分CaCO₃属于 ( )
A. 酸
B. 碱
C. 盐
D. 氧化物
A. 酸
B. 碱
C. 盐
D. 氧化物
答案:
C 碳酸钙是由钙离子和碳酸根构成的化合物,属于盐。
2 对盐的组成叙述正确的是 ( )
A. 都含有原子团
B. 都含有金属元素
C. 都不含有氢元素
D. 都含有非金属元素
A. 都含有原子团
B. 都含有金属元素
C. 都不含有氢元素
D. 都含有非金属元素
答案:
D A(×):大部分含氯离子的盐(如NaCl)中不含原子团。B、C(×):铵盐中含有氢元素,不含金属元素。D(√):盐中有酸根,酸根中都含有非金属元素,因此,盐中都含有非金属元素。
3 下列关于盐的溶解性的叙述正确的是 ( )
A. 硝酸盐都能溶于水
B. 碳酸盐都不溶于水
C. 硫酸盐都溶于水
D. 磷酸盐都易溶于水
A. 硝酸盐都能溶于水
B. 碳酸盐都不溶于水
C. 硫酸盐都溶于水
D. 磷酸盐都易溶于水
答案:
A 硝酸盐都能溶于水;碳酸盐除K₂CO₃、Na₂CO₃、(NH₄)₂CO₃等溶于水外,其他多数均不溶于水;硫酸盐除PbSO₄、BaSO₄等不溶于水、CaSO₄等微溶于水外,其他多数均溶于水;磷酸盐除K₃PO₄、Na₃PO₄、(NH₄)₃PO₄等溶于水外,其他多数均不溶于水。
4 将洁净的铁丝浸入含硝酸铜和硝酸锌的混合溶液中,一段时间后取出,铁丝表面覆盖了一层物质,这层物质是 ( )
A. 锌
B. 铜
C. 铜和锌
D. 铁和锌
A. 锌
B. 铜
C. 铜和锌
D. 铁和锌
答案:
B 金属活动性顺序中,排在前面的金属能将排在后面的金属从其盐溶液中置换出来。根据金属活动性顺序:锌>铁>铜,铁不能与硝酸锌反应,铁可以与硝酸铜反应生成铜和硝酸亚铁,故一段时间后取出,铁丝表面覆盖的物质是铜,B项正确。
5 小明绘制了硫酸铜的化学性质的思维导图,如图所示(“—”表示相连的物质能发生化学反应)。图中A、B、C、D所代表的物质不正确的是 ( )
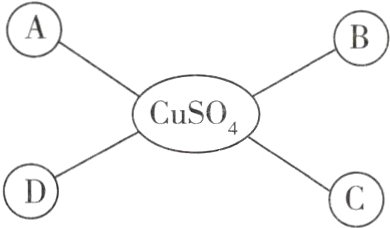
A. 铁
B. 稀盐酸
C. 氢氧化钠溶液
D. 氯化钡溶液

A. 铁
B. 稀盐酸
C. 氢氧化钠溶液
D. 氯化钡溶液
答案:
B 盐可与某些金属、酸、碱、盐等反应。A(√):Fe + CuSO₄ = FeSO₄ + Cu。B(×):CuSO₄与HCl相互交换成分,没有沉淀、气体或水生成,二者不能发生反应。C(√):2NaOH + CuSO₄ = Cu(OH)₂↓ + Na₂SO₄。D(√):BaCl₂ + CuSO₄ = CuCl₂ + BaSO₄↓。
6 下列实验能观察到明显现象的是 ( )
A. 氢氧化钠溶液滴入氯化钡溶液中
B. 稀盐酸滴入硫酸钠溶液中
C. 硝酸银溶液滴入氯化钠溶液中
D. 硫酸钠溶液滴入氯化铜溶液中
A. 氢氧化钠溶液滴入氯化钡溶液中
B. 稀盐酸滴入硫酸钠溶液中
C. 硝酸银溶液滴入氯化钠溶液中
D. 硫酸钠溶液滴入氯化铜溶液中
答案:
C 氢氧化钠与氯化钡不反应,无明显现象。稀盐酸与硫酸钠不反应,无明显现象。硝酸银与氯化钠反应生成氯化银白色沉淀,现象明显。硫酸钠与氯化铜不反应,无明显现象。
7 下列各组物质充分混合后,所得溶液的质量比反应前溶液的总质量增加的是 ( )
A. 镁和氯化铜溶液
B. 氧化铜粉末和稀硫酸
C. 氯化铁溶液和氢氧化钠溶液
D. 氢氧化钠溶液和稀盐酸
A. 镁和氯化铜溶液
B. 氧化铜粉末和稀硫酸
C. 氯化铁溶液和氢氧化钠溶液
D. 氢氧化钠溶液和稀盐酸
答案:
B A(×):镁和氯化铜反应生成氯化镁和铜,每24份质量的镁参与反应能置换出64份质量的铜,故溶液质量减小。B(√):氧化铜粉末和稀硫酸反应生成硫酸铜和水,故溶液质量增加。C(×):氯化铁和氢氧化钠反应生成氢氧化铁沉淀和氯化钠,有沉淀生成,溶液质量减小。D(×):氢氧化钠和稀盐酸反应生成氯化钠和水,溶液质量不变。
8 下表是部分物质的溶解性表(室温),利用表中提供的信息回答下列问题:

(1) 判断下列反应是否能够发生,说明理由。
① NaOH溶液和Ba(NO₃)₂溶液:________。
② Ba(OH)₂溶液和Na₂CO₃溶液:________。
(2) 按要求写出下列化学方程式。
①中和反应:__________________________(写一个,下同)。
②有气体生成的复分解反应:__________________________。
③两种盐的复分解反应:__________________________。
④有BaSO₄生成的复分解反应:__________________________。

(1) 判断下列反应是否能够发生,说明理由。
① NaOH溶液和Ba(NO₃)₂溶液:________。
② Ba(OH)₂溶液和Na₂CO₃溶液:________。
(2) 按要求写出下列化学方程式。
①中和反应:__________________________(写一个,下同)。
②有气体生成的复分解反应:__________________________。
③两种盐的复分解反应:__________________________。
④有BaSO₄生成的复分解反应:__________________________。
答案:
(1)①不能发生反应,因为两种化合物相互交换成分后,没有沉淀、气体或水生成
②能发生反应,因为两种化合物相互交换成分后生成的碳酸钡不溶于水
(2)①HCl + NaOH = NaCl + H₂O
②Na₂CO₃ + 2HCl = 2NaCl + H₂O + CO₂↑
③Na₂CO₃ + CaCl₂ = CaCO₃↓ + 2NaCl
④Na₂SO₄ + BaCl₂ = BaSO₄↓ + 2NaCl(以上答案合理即可)
【解析】
(2)①中和反应是指酸和碱发生的化学反应,所以只要写一种酸和一种碱反应的化学方程式即可。②有气体生成的复分解反应,可考虑酸与碳酸盐的反应。③两种盐的复分解反应可考虑可溶性的硫酸盐(或碳酸盐)和可溶性的钡盐(或钙盐)反应等。④有硫酸钡生成的复分解反应要求反应物中分别含有钡离子和硫酸根,但如果选择碱与盐或盐与盐的反应,应选择可溶性的碱和可溶性的盐。
(1)①不能发生反应,因为两种化合物相互交换成分后,没有沉淀、气体或水生成
②能发生反应,因为两种化合物相互交换成分后生成的碳酸钡不溶于水
(2)①HCl + NaOH = NaCl + H₂O
②Na₂CO₃ + 2HCl = 2NaCl + H₂O + CO₂↑
③Na₂CO₃ + CaCl₂ = CaCO₃↓ + 2NaCl
④Na₂SO₄ + BaCl₂ = BaSO₄↓ + 2NaCl(以上答案合理即可)
【解析】
(2)①中和反应是指酸和碱发生的化学反应,所以只要写一种酸和一种碱反应的化学方程式即可。②有气体生成的复分解反应,可考虑酸与碳酸盐的反应。③两种盐的复分解反应可考虑可溶性的硫酸盐(或碳酸盐)和可溶性的钡盐(或钙盐)反应等。④有硫酸钡生成的复分解反应要求反应物中分别含有钡离子和硫酸根,但如果选择碱与盐或盐与盐的反应,应选择可溶性的碱和可溶性的盐。
查看更多完整答案,请扫码查看


