1 [2023怀化中考]向Cu(NO₃)₂溶液中分别加入金属X、Y,反应一段时间后在X表面有红色物质析出,Y表面无明显变化,则X、Y、Cu三种金属的活动性由强到弱的顺序为 ( )
A. Cu > X > Y
B. X > Cu > Y
C. X > Y > Cu
D. Y > Cu > X
A. Cu > X > Y
B. X > Cu > Y
C. X > Y > Cu
D. Y > Cu > X
答案:
B 在金属活动性顺序中,位于前面的金属能把排在它后面的金属从其盐溶液中置换出来。分别将X、Y两种金属插入Cu(NO₃)₂溶液中,一段时间后,在X表面有红色固体析出,在Y表面无明显变化,说明X的金属活动性比铜强,Y的金属活动性比铜弱,即X > Cu > Y,B项正确。
2 在水中加入下列各组物质,没有沉淀产生的是 ( )
A. 氢氧化钙溶液和硫酸铜溶液
B. 碳酸钙和稀盐酸
C. 氢氧化钠溶液和氯化铁溶液
D. 硫酸钠溶液和硝酸钡溶液
A. 氢氧化钙溶液和硫酸铜溶液
B. 碳酸钙和稀盐酸
C. 氢氧化钠溶液和氯化铁溶液
D. 硫酸钠溶液和硝酸钡溶液
答案:
B A(×):氢氧化钙溶液和硫酸铜溶液反应生成氢氧化铜沉淀。B(√):碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳气体,无沉淀生成。C(×):氢氧化钠溶液和氯化铁溶液反应生成氢氧化铁沉淀。D(×):硫酸钠溶液和硝酸钡溶液反应生成硫酸钡沉淀。
3 [2023陕西中考]用下列各组物质进行实验,能验证Mg、Ag、Cu三种金属活动性强弱的是 ( )
A. Mg、Ag、Cu、稀硫酸
B. Mg、Ag、CuSO₄溶液
C. Ag、Cu、MgCl₂溶液
D. Ag、CuCl₂溶液、MgSO₄溶液
A. Mg、Ag、Cu、稀硫酸
B. Mg、Ag、CuSO₄溶液
C. Ag、Cu、MgCl₂溶液
D. Ag、CuCl₂溶液、MgSO₄溶液
答案:
B

续表选项 实验过程 现象分析 结论
①:镁条表面
B Mg、A、CusO溶液 有红色固体 金属活动性顺序:析出。②:无 Mg>Cu>Ag
明显现象
金属活动性顺序:
C A①g、Cu、M ①②:均无明 ACgu<和MAgg、Cu的<金Mg属,显现象 活动性顺序无法判断
金属活动性顺序:
D Ag、CuCI溶液、MgSO溶液①显②现象:均无明 ACgu<和CMug、A的g金<属Mg活,动性顺序无法判断
规律方法
验证金属活动性顺序的实验方法
1. 验证两种金属的活动性顺序
方法一:“金属 + 稀盐酸”,观察是否产生气泡。

等体积、等浓度的稀盐酸(或稀硫酸)观察是否有气泡产生
(在金属活动性顺序表中,若两种金属都排在氢前面,只能用方法二)
方法二:“一种金属单质 + 另一种金属的盐溶液”,观察是否有固体生成。

观察金属片表面是否有固体生成
2. 验证三种金属的活动性顺序
先将三种金属按正确的顺序排列:A > B > C。
方法一:取“金属A + B的盐溶液,B的盐溶液 + 金属C”,即“两金夹一盐”,观察现象。

观察A、C表面是否有固体生成
方法二:取“A的盐溶液 + 金属B,金属B + C的盐溶液”,即“两盐夹一金”,观察现象。

观察两支试管中B表面是否有固体生成
B

续表选项 实验过程 现象分析 结论
①:镁条表面
B Mg、A、CusO溶液 有红色固体 金属活动性顺序:析出。②:无 Mg>Cu>Ag
明显现象
金属活动性顺序:
C A①g、Cu、M ①②:均无明 ACgu<和MAgg、Cu的<金Mg属,显现象 活动性顺序无法判断
金属活动性顺序:
D Ag、CuCI溶液、MgSO溶液①显②现象:均无明 ACgu<和CMug、A的g金<属Mg活,动性顺序无法判断
规律方法
验证金属活动性顺序的实验方法
1. 验证两种金属的活动性顺序
方法一:“金属 + 稀盐酸”,观察是否产生气泡。

等体积、等浓度的稀盐酸(或稀硫酸)观察是否有气泡产生
(在金属活动性顺序表中,若两种金属都排在氢前面,只能用方法二)
方法二:“一种金属单质 + 另一种金属的盐溶液”,观察是否有固体生成。

观察金属片表面是否有固体生成
2. 验证三种金属的活动性顺序
先将三种金属按正确的顺序排列:A > B > C。
方法一:取“金属A + B的盐溶液,B的盐溶液 + 金属C”,即“两金夹一盐”,观察现象。

观察A、C表面是否有固体生成
方法二:取“A的盐溶液 + 金属B,金属B + C的盐溶液”,即“两盐夹一金”,观察现象。

观察两支试管中B表面是否有固体生成
4 [新情境][2024青岛中考]《神农本草经》中有石胆“能化铁为铜”的记载。石胆的主要成分是CuSO₄·5H₂O,溶于水得到硫酸铜溶液。下列说法正确的是 ( )
A. 石胆溶于水,溶液呈黄色
B. 石胆化铁为铜发生了复分解反应
C. 石胆也能化锌为铜
D. 铁、铜都能与稀盐酸反应产生氢气
A. 石胆溶于水,溶液呈黄色
B. 石胆化铁为铜发生了复分解反应
C. 石胆也能化锌为铜
D. 铁、铜都能与稀盐酸反应产生氢气
答案:
C A(×):石胆的主要成分是CuSO₄·5H₂O,溶于水得到硫酸铜溶液,硫酸铜溶液呈蓝色。B(×):复分解反应是两种化合物互相交换成分生成另外两种化合物的化学反应,石胆化铁为铜的原理是硫酸铜与铁反应生成铜和硫酸亚铁,不属于复分解反应,该反应符合一种单质与一种化合物反应生成另一种单质和另一种化合物,属于置换反应。C(√):锌的金属活动性比铜强,锌能与硫酸铜反应生成铜和硫酸锌,因此石胆也能化锌为铜。D(×):铁能与稀盐酸反应生成氢气,铜与稀盐酸不反应。
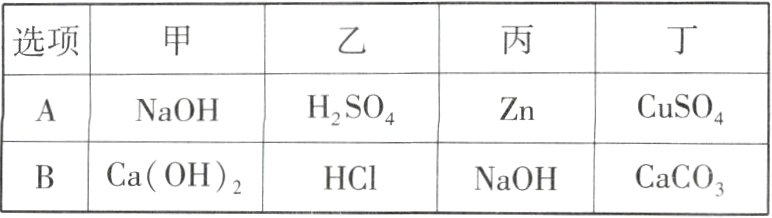
5 [2023天津中考]如图所示为甲、乙、丙、丁四种物质间的相互关系,涉及的反应均为初中化学常见反应(“—”表示相连的两种物质能反应,“→”表示通过一步反应能实现转化),下列选项符合图示关系的是 ( )

答案:
D 各物质的转化关系如下(“×”表示不能通过一步反应实现转化或相连的两种物质不能反应)。
A项:

B项:

C项:

D项:

D 各物质的转化关系如下(“×”表示不能通过一步反应实现转化或相连的两种物质不能反应)。
A项:

B项:

C项:

D项:

6 学习了单质、氧化物、酸、碱、盐的性质后,发现有很多不同类别的物质在发生反应时都有盐生成(其他物质省略),如图所示。请回答下列问题:

(1) 若生成的盐是硫酸钾,则①中发生反应的化学方程式为__________________________。
(2) 若生成的盐是氯化亚铁,则在已显示的变化中可以通过置换反应来实现的有________(填序号)。
(3) 若生成的盐是硝酸铜,由⑦来实现的化学方程式可能为__________________________。
(4) 图中⑤处应补充的文字是__________________________(写一种,不能与图中已有信息重复)。

(1) 若生成的盐是硫酸钾,则①中发生反应的化学方程式为__________________________。
(2) 若生成的盐是氯化亚铁,则在已显示的变化中可以通过置换反应来实现的有________(填序号)。
(3) 若生成的盐是硝酸铜,由⑦来实现的化学方程式可能为__________________________。
(4) 图中⑤处应补充的文字是__________________________(写一种,不能与图中已有信息重复)。
答案:
(1)2KOH + H₂SO₄ = K₂SO₄ + 2H₂O
(2)④⑥
(3)CuSO₄ + Ba(NO₃)₂ = BaSO₄↓ + Cu(NO₃)₂[或2AgNO₃ + CuCl₂ = 2AgCl↓ + Cu(NO₃)₂等]
(4)金属氧化物 + 酸(或碱 + 非金属氧化物等)
【解析】
(1)①为酸碱中和反应,若由此反应生成硫酸钾,则此处应为氢氧化钾与稀硫酸反应生成硫酸钾和水的反应。
(2)图中④⑥为置换反应,如铁与稀盐酸反应生成氯化亚铁和氢气,铁与氯化铜溶液反应生成氯化亚铁和铜。
(3)⑦为盐与盐发生的复分解反应,反应物均可溶,产物之一为沉淀,若由此反应生成硝酸铜,则另一种生成物为沉淀,如硫酸铜与硝酸钡溶液反应生成硫酸钡沉淀和硝酸铜。
(1)2KOH + H₂SO₄ = K₂SO₄ + 2H₂O
(2)④⑥
(3)CuSO₄ + Ba(NO₃)₂ = BaSO₄↓ + Cu(NO₃)₂[或2AgNO₃ + CuCl₂ = 2AgCl↓ + Cu(NO₃)₂等]
(4)金属氧化物 + 酸(或碱 + 非金属氧化物等)
【解析】
(1)①为酸碱中和反应,若由此反应生成硫酸钾,则此处应为氢氧化钾与稀硫酸反应生成硫酸钾和水的反应。
(2)图中④⑥为置换反应,如铁与稀盐酸反应生成氯化亚铁和氢气,铁与氯化铜溶液反应生成氯化亚铁和铜。
(3)⑦为盐与盐发生的复分解反应,反应物均可溶,产物之一为沉淀,若由此反应生成硝酸铜,则另一种生成物为沉淀,如硫酸铜与硝酸钡溶液反应生成硫酸钡沉淀和硝酸铜。
7 [2024陕西中考]化学课堂上,老师为同学们演示了如图所示的实验。

(1) 铜丝插入AgNO₃溶液一段时间后,观察到的两个现象分别是______________________,发生反应的化学方程式是______________。
(2) 铝丝表面析出红色固体时,试管内溶液中的溶质一定有______________________。

(1) 铜丝插入AgNO₃溶液一段时间后,观察到的两个现象分别是______________________,发生反应的化学方程式是______________。
(2) 铝丝表面析出红色固体时,试管内溶液中的溶质一定有______________________。
答案:
(1)铜丝表面析出银白色固体、溶液由无色变成蓝色 Cu + 2AgNO₃ = Cu(NO₃)₂ + 2Ag
(2)硝酸铝[或Al(NO₃)₃]
【解析】
(2)取出铜丝,溶液中一定含有Cu(NO₃)₂,可能含有AgNO₃。再插入铝丝,若有AgNO₃,铝会先与AgNO₃反应,再与Cu(NO₃)₂反应。铝丝表面析出红色固体,说明即使有AgNO₃也已经完全反应,且Cu(NO₃)₂参加了反应(是否完全反应未知),则试管内溶液中的溶质一定含有生成的Al(NO₃)₃,可能含有Cu(NO₃)₂。
(1)铜丝表面析出银白色固体、溶液由无色变成蓝色 Cu + 2AgNO₃ = Cu(NO₃)₂ + 2Ag
(2)硝酸铝[或Al(NO₃)₃]
【解析】
(2)取出铜丝,溶液中一定含有Cu(NO₃)₂,可能含有AgNO₃。再插入铝丝,若有AgNO₃,铝会先与AgNO₃反应,再与Cu(NO₃)₂反应。铝丝表面析出红色固体,说明即使有AgNO₃也已经完全反应,且Cu(NO₃)₂参加了反应(是否完全反应未知),则试管内溶液中的溶质一定含有生成的Al(NO₃)₃,可能含有Cu(NO₃)₂。
查看更多完整答案,请扫码查看


