易错点1 对盐的认识错误
1. 下列有关盐的说法正确的是 ( )
A. 盐就是 NaCl
B. 纯碱不是碱
C. 盐的组成中一定含有金属元素
D. 某固体能与稀盐酸反应产生气体,证明该固体中一定含${CO_{3}^{2 - }}$
1. 下列有关盐的说法正确的是 ( )
A. 盐就是 NaCl
B. 纯碱不是碱
C. 盐的组成中一定含有金属元素
D. 某固体能与稀盐酸反应产生气体,证明该固体中一定含${CO_{3}^{2 - }}$
答案:
B
A(×):盐是一类物质的统称,氯化钠属于盐。
B(√):纯碱的化学式为Na₂CO₃,属于盐,不属于碱。
C(×):大多数盐是由金属离子和酸根离子构成的,但铵盐是由铵根离子和酸根离子构成的,不含金属元素。
D(×):某固体中加入稀盐酸,产生了无色气体,说明该固体中可能含有CO₃²⁻或HCO₃⁻,也可能含有活泼金属。
A(×):盐是一类物质的统称,氯化钠属于盐。
B(√):纯碱的化学式为Na₂CO₃,属于盐,不属于碱。
C(×):大多数盐是由金属离子和酸根离子构成的,但铵盐是由铵根离子和酸根离子构成的,不含金属元素。
D(×):某固体中加入稀盐酸,产生了无色气体,说明该固体中可能含有CO₃²⁻或HCO₃⁻,也可能含有活泼金属。
易错点2 对复分解反应认识不清
2. 下列有关复分解反应的说法一定正确的是 ( )
A. 元素化合价改变
B. 一定有气体或者沉淀生成
C. 元素的存在形态不改变
D. 中和反应不一定属于复分解反应
2. 下列有关复分解反应的说法一定正确的是 ( )
A. 元素化合价改变
B. 一定有气体或者沉淀生成
C. 元素的存在形态不改变
D. 中和反应不一定属于复分解反应
答案:
C
A(×):复分解反应是两种化合物相互交换成分生成另外两种化合物,反应前后元素化合价不变。
B(×):复分解反应有水或者气体或者沉淀生成,三个条件满足其一就可以。
C(√):复分解反应是两种化合物相互交换成分生成另外两种化合物,元素的存在形态不改变。
D(×):中和反应是酸与碱作用生成盐和水的反应,一定是复分解反应。
A(×):复分解反应是两种化合物相互交换成分生成另外两种化合物,反应前后元素化合价不变。
B(×):复分解反应有水或者气体或者沉淀生成,三个条件满足其一就可以。
C(√):复分解反应是两种化合物相互交换成分生成另外两种化合物,元素的存在形态不改变。
D(×):中和反应是酸与碱作用生成盐和水的反应,一定是复分解反应。
疑难点 金属活动性顺序的应用
1. [2024 滨州中考]下列各组试剂不能验证铁、铜、银三种金属活动性强弱的是 ( )
A. ${CuSO}_{4}$溶液 Fe Ag
B. ${FeSO}_{4}$溶液 稀${H_{2}SO_{4}}$ Cu Ag
C. ${AgNO}_{3}$溶液 稀${H_{2}SO_{4}}$ Fe Cu
D. ${AgNO}_{3}$溶液 ${FeSO}_{4}$溶液 Cu
1. [2024 滨州中考]下列各组试剂不能验证铁、铜、银三种金属活动性强弱的是 ( )
A. ${CuSO}_{4}$溶液 Fe Ag
B. ${FeSO}_{4}$溶液 稀${H_{2}SO_{4}}$ Cu Ag
C. ${AgNO}_{3}$溶液 稀${H_{2}SO_{4}}$ Fe Cu
D. ${AgNO}_{3}$溶液 ${FeSO}_{4}$溶液 Cu
答案:
B
根据各选项中试剂设计合理的实验方案及得到的实验结论如下:
选项 实验方案 实验结论:金属活动性
A Fe + CuSO₄溶液 Fe>Cu
Ag + CuSO₄溶液 Cu>Ag
C Fe + H₂SO₄ Fe>Cu
Cu + H₂SO₄
Cu + AgNO₃溶液 Cu>Ag
D Cu + AgNO₃溶液 Cu>Ag
Cu + FeSO₄溶液 Fe>Cu
B选项无法验证铁、铜、银三种金属的活动性顺序。
根据各选项中试剂设计合理的实验方案及得到的实验结论如下:
选项 实验方案 实验结论:金属活动性
A Fe + CuSO₄溶液 Fe>Cu
Ag + CuSO₄溶液 Cu>Ag
C Fe + H₂SO₄ Fe>Cu
Cu + H₂SO₄
Cu + AgNO₃溶液 Cu>Ag
D Cu + AgNO₃溶液 Cu>Ag
Cu + FeSO₄溶液 Fe>Cu
B选项无法验证铁、铜、银三种金属的活动性顺序。
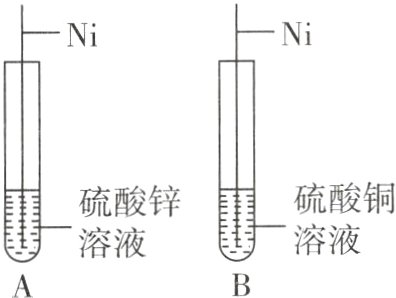
2. [2024 临夏中考]金属镍在制造钱币、不锈钢、催化剂等方面有着广泛的应用。为探究镍(Ni)、锌、铜的金属活动性顺序,小明做了如图所示的实验,发现 A 试管中镍丝表面无现象,B 试管中镍丝表面出现红色物质,则三种金属活动性由强到弱的顺序是 ( )
A. Ni、$Zn$、Cu
B. $Zn$、Cu、Ni
C. $Zn$、Ni、Cu
D. Cu、Ni、Zn

A. Ni、$Zn$、Cu
B. $Zn$、Cu、Ni
C. $Zn$、Ni、Cu
D. Cu、Ni、Zn
答案:
C
根据金属活动性顺序的应用可知,排在金属活动性顺序中前面的金属可以把排在后面的金属从其盐溶液里置换出来。据题意可知,A试管中镍丝表面无现象,说明镍没有置换出硫酸锌溶液中的锌,镍不如锌活泼;B试管中镍丝表面出现红色物质,说明镍置换出硫酸铜溶液中的铜,镍比铜活泼。所以三种金属活动性由强到弱的顺序是Zn、Ni、Cu。
根据金属活动性顺序的应用可知,排在金属活动性顺序中前面的金属可以把排在后面的金属从其盐溶液里置换出来。据题意可知,A试管中镍丝表面无现象,说明镍没有置换出硫酸锌溶液中的锌,镍不如锌活泼;B试管中镍丝表面出现红色物质,说明镍置换出硫酸铜溶液中的铜,镍比铜活泼。所以三种金属活动性由强到弱的顺序是Zn、Ni、Cu。
3. [新题型·工艺流程题][2024 连云港中考]一种以黄铜渣(含 Zn、Cu、ZnO、CuO)为原料获取 Cu 和${ZnSO_{4}}$溶液的实验流程如下。下列说法正确的是 ( )

A. 加入稀${H_{2}SO_{4}}$生成${H_{2}}$的化学方程式为Cu + ${H_{2}SO_{4}}$=${CuSO}_{4}$ + ${H_{2}}$↑
B. 根据流程可以判断 Zn 的金属活动性比 Cu 的强
C. 判断加入的$Zn$已过量的依据是溶液中有固体剩余
D. 流程中涉及的化学反应类型均为置换反应

A. 加入稀${H_{2}SO_{4}}$生成${H_{2}}$的化学方程式为Cu + ${H_{2}SO_{4}}$=${CuSO}_{4}$ + ${H_{2}}$↑
B. 根据流程可以判断 Zn 的金属活动性比 Cu 的强
C. 判断加入的$Zn$已过量的依据是溶液中有固体剩余
D. 流程中涉及的化学反应类型均为置换反应
答案:
B
以黄铜渣(含Zn、Cu、ZnO、CuO)为原料获取Cu和ZnSO₄溶液的实验流程中,发生的反应如图所示:

A(×):铜在金属活动性顺序中排在氢后面,不能与稀H₂SO₄反应。
B(√):锌能与硫酸铜反应,可以判断Zn的金属活动性比Cu的强。
C(×):判断加入的Zn已过量的依据是溶液由蓝色变为无色(不含Cu²⁺)。
D(×):上述流程中锌与稀硫酸、硫酸铜溶液的反应为置换反应,氧化锌、氧化铜与稀硫酸的反应为复分解反应。
B
以黄铜渣(含Zn、Cu、ZnO、CuO)为原料获取Cu和ZnSO₄溶液的实验流程中,发生的反应如图所示:

A(×):铜在金属活动性顺序中排在氢后面,不能与稀H₂SO₄反应。
B(√):锌能与硫酸铜反应,可以判断Zn的金属活动性比Cu的强。
C(×):判断加入的Zn已过量的依据是溶液由蓝色变为无色(不含Cu²⁺)。
D(×):上述流程中锌与稀硫酸、硫酸铜溶液的反应为置换反应,氧化锌、氧化铜与稀硫酸的反应为复分解反应。
4. [新题型·工艺流程题][2023 重庆西南大学附中月考]从废旧手机的某些部件中可回收银和铜,其操作流程如图所示:

(1)请写出步骤Ⅰ中发生反应的化学方程式:____________________(写出一个即可)。
(2)步骤Ⅱ中,加入硝酸银溶液的作用是____。
(3)步骤Ⅲ中,若 M 为锌,则反应结束后溶液乙的质量______(填“大于”“小于”或“等于”)溶液甲。

(1)请写出步骤Ⅰ中发生反应的化学方程式:____________________(写出一个即可)。
(2)步骤Ⅱ中,加入硝酸银溶液的作用是____。
(3)步骤Ⅲ中,若 M 为锌,则反应结束后溶液乙的质量______(填“大于”“小于”或“等于”)溶液甲。
答案:
(1)Mg + H₂SO₄ = MgSO₄ + H₂↑[或2Al + 3H₂SO₄ = Al₂(SO₄)₃ + 3H₂↑]
(2)硝酸银溶液与铜反应,除去固体中的铜
(3)大于
[解析]
(1)镁、铝较活泼,铜、银不活泼,足量的稀硫酸可将镁、铝完全溶解,留下固体铜、银。
(2)向固体中加入硝酸银溶液,铜与硝酸银溶液反应生成硝酸铜和银,可除去固体中的铜。
(3)溶液甲中的溶质是硝酸铜,若M为Zn,锌能与硝酸铜反应生成铜与硝酸锌,根据反应的化学方程式:Zn + Cu(NO₃)₂ = Zn(NO₃)₂ + Cu,每65份质量的锌反应后生成64份质量的铜,则反应后溶液的质量增大,故反应结束后溶液乙的质量大于溶液甲。
(1)Mg + H₂SO₄ = MgSO₄ + H₂↑[或2Al + 3H₂SO₄ = Al₂(SO₄)₃ + 3H₂↑]
(2)硝酸银溶液与铜反应,除去固体中的铜
(3)大于
[解析]
(1)镁、铝较活泼,铜、银不活泼,足量的稀硫酸可将镁、铝完全溶解,留下固体铜、银。
(2)向固体中加入硝酸银溶液,铜与硝酸银溶液反应生成硝酸铜和银,可除去固体中的铜。
(3)溶液甲中的溶质是硝酸铜,若M为Zn,锌能与硝酸铜反应生成铜与硝酸锌,根据反应的化学方程式:Zn + Cu(NO₃)₂ = Zn(NO₃)₂ + Cu,每65份质量的锌反应后生成64份质量的铜,则反应后溶液的质量增大,故反应结束后溶液乙的质量大于溶液甲。
查看更多完整答案,请扫码查看


